物种的遗传多样性是指同一物种不同个体之间以及不同物种之间所存在的遗传差异程度(马克平和钱迎倩, 1998)。它既是生物多样性的重要组成部分, 也是物种多样性、谱系多样性、功能多样性、生态系统多样性等其他多样性层次或维度的重要基础(Cires et al, 2011)。遗传多样性是物种生存和进化的基石(Reid et al, 1993), 一般来说, 植物遗传变异的大小与其未来命运和进化潜力密切相关(刘张璐, 2010)。遗传多样性高的物种或群体更容易适应外界快速变化的环境, 从而更能应对不良环境的选择压力, 具有更高的进化潜力(Solomon et al, 2019); 遗传多样性水平低的物种或自然群体适应外界自然环境变化的能力就会越低, 有时甚至会趋向灭绝(Huenneke, 1991)。为什么低遗传多样性的物种或自然群体会趋向灭绝? 以往人们只是将原因简单地归咎于物种本身的进化历史和遗传结构。
近年来, 随着分子生物学特别是高通量测序技术的发展, 人们可以从基因组层面更深入地了解物种的遗传结构和进化历史, 利用大量的分子标记构建物种间相对稳健、可信的亲缘关系(Fu et al, 2014)。基因分型测序技术(genotyping by sequencing, GBS)可以捕获大量全基因组水平的单核苷酸多态性(SNP)位点, 具有低成本、耗时短及高通量开发非模式物种的SNP分子标记等优点(Miller et al, 2007)。因此, 越来越多的研究者利用该技术开展保护遗传学、分子育种、性状图谱构建、优质种质资源遗传多样性分析等研究(Pegadaraju et al, 2013)。荷叶铁线蕨(Adiantum nelumboides)分布于我国长江三峡地区。该种外形独特, 最早被处理为原产非洲东部地区的肾叶铁线蕨的变种(A. reniforme var. sinensis)。近年来分子系统学、细胞学及形态学等研究结果表明该物种是和肾叶铁线蕨(六倍体)亲缘关系紧密的四倍体(Wang et al, 2015), 并被提升为独立物种。由于三峡工程的建设, 荷叶铁线蕨部分生境被淹没; 再加上具有较高的观赏价值和药用价值(陈绍成, 2014), 因此生态环境的破坏和人工采挖可能是导致其数量迅速减少、分布范围急剧狭缩的主要因素(Wu et al, 2003)。目前, 该物种正处于灭绝的边缘, 《国家重点保护野生植物名录》(2021版) (
荷叶铁线蕨的遗传多样性研究一直存在争议。基于基因组随机扩增多态性DNA标记(random amplified polymorphic DNA, RAPD)的研究结果显示, 荷叶铁线蕨的居群内部和居群间均存在遗传分化, 其遗传多样性相关指数中等偏下, 居群之间存在一定的基因流; 但等位酶标记的研究结果表明, 荷叶铁线蕨居群内的遗传多样性和居群间的遗传分化水平比其他蕨类植物低(潘丽芹等, 2005)。然而, 无论遗传多样性高低, 荷叶铁线蕨的濒危原因均指向三峡地区严重的环境破坏和野生群体的过度开发利用(黄至欢, 2020)。因此, 我们认为应从该物种自身的全基因组水平遗传变异及分布格局、群体进化历史等方面探讨荷叶铁线蕨的濒危机制。
本研究在长江三峡地区采集6个居群共28个荷叶铁线蕨样本, 进行基因组大小测定和简化基因组测序。旨在探明以下内容: (1)荷叶铁线蕨的基因组大小是否存在种群间的变异? (2)荷叶铁线蕨基因组的GC含量及基因组结构的稳定性; (3)荷叶铁线蕨居群内部及居群间的遗传多样性大小; (4)荷叶铁线蕨的群体遗传结构及种群间基因流水平; (5)荷叶铁线蕨的种群动态历史; (6)通过模拟不同气候情景下的潜在分布区变化来拟合荷叶铁线蕨的遗传多样性与种群历史和未来动态的一致性, 从而更深入地探讨荷叶铁线蕨可能的濒危原因, 为荷叶铁线蕨的保护提供科学依据。荷叶铁线蕨作为中国生物多样性保护中的旗舰物种, 其保护基因组学分析有助于更深入地理解当前日益增加的濒危物种的保护机制。
1 材料和方法
1.1 植物材料
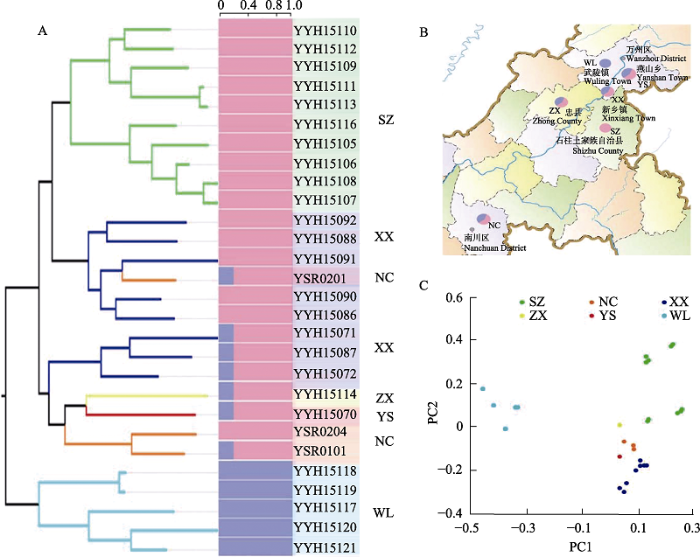
共有采自重庆市6个样点的28份试验材料, 基本覆盖了该植物的分布区, 样品按区域分布分组(表1), 每个样品取完整的叶片用硅胶干燥、备用, 凭证标本存放于上海辰山植物园植物标本室(CSH)。
表1 荷叶铁线蕨样品采集信息
Table 1
| 居群 Population | 采样地点 Sampling localities | 样本数量 Sample size | 样本采集号 Voucher no. |
|---|---|---|---|
| 石柱 SZ | 重庆市石柱县西沱镇 Xituo Town, Shizhu County, Chongqing | 10 | YYH15105, YYH15106, YYH15107, YYH15108, YYH15109, YYH15110, YYH15111, YYH15112, YYH15113, YYH15116 |
| 南川 NC | 重庆市南川区 Nanchuan District, Chongqing | 3 | YSR0101, YSR0201, YSR0204 |
| 新乡 XX | 重庆市万州区新乡镇 Xinxiang Town, Wanzhou District, Chongqing | 8 | YYH15091, YYH15071, YYH15072, YYH15088, YYH15087, YYH15092, YYH15090, YYH15086 |
| 燕山 YS | 重庆市万州区燕山乡 Yanshan Town, Wanzhou District, Chongqing | 1 | YYH15070 |
| 武陵 WL | 重庆市万州区武陵镇 Wuling Town, Wanzhou District, Chongqing | 5 | YYH15117, YYH15118, YYH15119, YYH15120, YYH15121 |
| 忠县 ZX | 重庆市忠县石宝镇 Shibao Town, Zhong County, Chongqing | 1 | YYH15114 |
1.2 DNA提取和GBS文库构建
采用改良的CTAB法提取DNA, 使用植物基因组DNA快速提取试剂盒(Biomed基因技术)从样品中分离总DNA。将通过琼脂糖凝胶电泳质量检测的样本送至北京诺禾致源生物信息科技有限公司进行限制性酶切位点关联DNA建库测序。取Mse I和Ecor I限制性内切酶进行酶切, 之后在片段两端加接头, PCR扩增含有接头的tag序列, 将样品混合后通过电泳回收DNA条带, 纯化后的产物在Illumina HiSeq测序平台上进行双末端150测序。
1.3 获取单核苷酸多态性(SNP)
依据建库样品对应关系拆分为单样品原始数据, 将下机测序得到的原始数据raw reads使用FastQC v 0.11.9软件进行质控, 去除测序接头以及引物序列; 切除质量值低于20的碱基。以荷叶铁线蕨全基因组作为参考, 利用BWA v 0.7.17比对软件(Li & Durbin, 2010)将样品过滤后的有效数据(clean reads)与参考基因组进行比对。使用Samtools v 1.14 软件加头, 去重复。运行GATK v 4.0进行变异检测, 即CALL SNP。将个体样本变异位点和基因型信息提取生成vcf格式文件来获得SNP标记。
通过进一步过滤筛选, 提高准确度。运行GATK软件使用参数“QD < 2.0 || FS > 60.0 || MQ < 40.0 || MQRankSum < -12.5 || ReadPosRankSum < -8.0”对vcf格式文件初步过滤, 得到包含26,578个SNP位点的vcf文件。使用vcftools v.4.1软件对获得SNP分型结果进行过滤,主要参数--maf 0.01 --minDP 4 --max-missing 0.8; 再进一步利用Plink v1.90软件进行哈迪温伯格平衡(HWE)和连锁不平衡(LD)过滤, 按P < 0.001, r2 < 0.01进行过滤; 过滤后剩下的高质量SNP用于群体遗传结构分析。
1.4 群体结构分析
用ADMIXTURE v1.3.0软件基于每个个体的基因型推断个体祖先成分, 对经过miss 0.4、maf 0.05过滤条件筛选后得到的SNP位点进行聚类分析, 参数设置为K = 1‒10, 每个K值重复10次运算, 运行代数为1,000,000, 舍弃前500,000代, 用最小交叉验证(cross validation, CV)错误值判断最佳K值。具体运行参数为admixture --cv out.recode.bed
用PGDspider2将获得的SNP数据转换为构建系统发育树的文件, 在IQ-TREE v1.7中根据最大似然法(maximum likelihood, ML)构建系统树, 最后使用FigTree v1.4.4对系统发育树进行可视化。同时, 在Plink中用PCA揭示群体结构并计算各主成分解释率。遗传结构分析均使用去除LD位点的SNP数据集, 在R中的ggplot2软件包绘制结果图。
1.5 遗传多样性分析
通过Stacks v2.41软件中的Populations子程序计算种间遗传分化系数(genetic differentiation, Fst)、物种水平的近交系数(inbreeding coefficient, Fis)、观测杂合度(observed heterozygosity, Ho)和期望杂合度(expected heterozygosity, He)及个体水平的Ho。同时基于所有(变异和非变异)位点计算核苷酸多态性(nucleotide diversity, π)和基因交流情况计算基因流(Nm)等遗传参数。
1.6 基因组大小估算
以玉米为内参, 基因组大小为2.3 Gb, 以嫩叶为试验材料, 待测样品DNA含量 = 内参DNA含量 × 待测样品的荧光强度/内参样品的荧光强度。待测样品的倍性 = 已知品种的倍性(田新民等, 2011)。
1.7 有效种群大小波动历史分析
将获得的SNP数据使用Stairway Plot v2推测荷叶铁线蕨在一千万年前到1 kya (thousand years ago, kya)间的群体的有效大小Ne变化。生成无缺失且无LD的SNP数据集, 将vcf文件用python脚本easySFS (
1.8 潜在分布区预测
根据材料采集和种质资源调查, 通过GPS实地定位获得分布点经纬度信息, 通过中国数字植物标本馆(
运行MaxEnt v 3.4.1软件(
2 结果
2.1 SNP位点数与GC含量统计
对28份荷叶铁线蕨样品进行测序得到高质量序列数据共29.6 Gb, 平均每样本1.06 Gb, GC含量为39%‒41% (附录1)。其中石柱群体的平均GC含量最高, 为40.81%; 南川群体最低, 为39.7%, 各群体间GC含量差异并不显著。所有的序列均通过质量阈值, 可以用于GBS文库的构建。测序样品Q30 > 88.97%, 选择荷叶铁线蕨基因组作为参考序列, 28个样本的序列利用BWA软件分别与参考序列进行比对。共观察到11,767个原始SNPs, 剔除了缺失5%以上的SNPs, 获得了9,423个高质量的SNPs, 用于群体遗传数据挖掘和分析。
2.2 基因组大小估测与染色体倍性分析
由表2可知, 内参与待测样品峰值完全分开, 无重叠峰, 峰型清晰集中, 待测样品均为四倍体。根据内参及待测样品的荧光强度, 待测荷叶铁线蕨的基因组大小相近, 基因组大小在5.01‒5.83 Gb之间。
表2 荷叶铁线蕨相对荧光强度
Table 2
| 样品 Sample | 倍性 Ploidy level | 内参荧光强度 Relative fluorescence intensity | 待测荧光 强度 Mean | 基因组大小 Genome size |
|---|---|---|---|---|
| YYH15105 | 4X | 62.96 | 151.86 | 5.55 |
| YYH15111 | 4X | 60.30 | 140.32 | 5.35 |
| YYH15112 | 4X | 60.06 | 130.77 | 5.01 |
| YYH15116 | 4X | 67.82 | 171.92 | 5.83 |
2.3 遗传多样性与遗传分化水平估算
对6个地理群体的遗传多样性信息进行统计分析(表3), 结果表明, 28份材料的平均观察杂合度(Ho)、期望杂合度(He)和核苷酸多样性(Pi)分别为0.138、0.232和0.373, 新乡居群的杂合度略高于其他居群。除武陵居群外, 期望杂合度均高于观测杂合度, 说明荷叶铁线蕨的分布面积减少、生境破碎化。核苷酸多样性(Pi)分析表明, 南川居群的核苷酸多样性高达0.683, 石柱居群、燕山居群、武陵居群和新乡居群Pi分别为0.316、0.117、0.54和0.48。Pi值越接近1, 说明该类群的核苷酸多样性越丰富, 适应环境的能力越强。由表4看出, 每个居群的近交系数(Fis)都大于0, 范围介于0‒0.303之间, 其平均值为0.143, 所有居群的近交系数都表现为显著的正值, 表明这些居群存在杂合子不足现象。
表3 不同居群荷叶铁线蕨遗传多样性。样品信息同表1。
Table 3
| 居群名称 Population | 观察杂合度 Ho | 期望杂合度 He | 核苷酸多样性 Pi | 近交系数 Fis |
|---|---|---|---|---|
| 石柱 SZ | 0.206 | 0.214 | 0.316 | 0.172 |
| 南川 NC | 0.211 | 0.287 | 0.683 | 0.27 |
| 新乡 XX | 0.104 | 0.285 | 0.1166 | 0 |
| 燕山 YS | 0.106 | 0.135 | 0.105 | 0 |
| 武陵 WL | 0.198 | 0.187 | 0.54 | 0.117 |
| 忠县 ZX | 0.218 | 0.286 | 0.48 | 0.303 |
| 平均值 Average | 0.173 | 0.232 | 0.373 | 0.143 |
Ho, Observed heterozygosity; He, Expected heterozygosity; π, Nucleotide diversity; Fis, Inbreeding coefficient.
表4 荷叶铁线蕨居群间的遗传分化系数(Fst: 对角线下)与基因流(Nm: 对角线上), 样品信息同表1。
Table 4
| 居群 Population | 石柱 SZ | 南川 NC | 燕山 YS | 忠县 ZX | 武陵 WL | 新乡 XX |
|---|---|---|---|---|---|---|
| 石柱 SZ | 1.108 | 1.957 | 2.023 | 2.486 | 2.157 | |
| 南川 NC | 0.0216 | 1.795 | 2.417 | 2.186 | 1.957 | |
| 燕山 YS | 0.0194 | 0.0312 | 1.864 | 2.167 | 2.035 | |
| 忠县 ZX | 0.0165 | 0.0216 | 0.0183 | 2.341 | 1.628 | |
| 武陵 WL | 0.0186 | 0.0298 | 0.0161 | 0.0176 | 1.439 | |
| 新乡 XX | 0.0154 | 0.0251 | 0.0148 | 0.0193 | 0.0169 |
2.4 群体遗传结构分析
基于9,423个核SNP位点进行Structure分析, 结果如图1A所示。当K = 2时, CV值最小, 将供试材料划分为2个遗传分组, 石柱居群、忠县居群、南川居群、燕山居群和新乡居群聚为一个遗传分组, 而武陵居群单独聚为另一个遗传分组; 两个遗传分组之间的分化时间可能较早。同时发现, 两个遗传分组之间存在着一定程度的基因交流或遗传渐渗, 尤其是南川居群和新乡居群中存在一定比例的分组间共享遗传变异。
图1
图1
基于SNP的荷叶铁线蕨遗传结构分析。A: 当K = 2时每个个体的遗传成分分析结果和基于9,423个SNP的最大似然法建树结果示。每一个柱形代
Fig. 1
Analysis of population structure based on identified SNP. A, Results of the admixture proportions for each individual with K = 2 and maximum likelihood tree based on 9,423 SNPs. Each sample is represented by a histogram, which is partitioned into different colors. Each color represents a genetic cluster. Numbers in the nodes are the bootstrap values from 100 replicates; B, The distribution of best results in clusters by Structure. The pie chart represents the genetic cluster of each population; C, Results of the principal component analysis. Each sample is represented by a point. The sample information is shown in
利用最大似然法(ML)基于9,423个SNP位点对28个样本构建的系统进化树显示(图1A), 28个荷叶铁线蕨样本聚类成2个大的遗传分支。除YSR0201和YYH15070样品外其他样品按地理分布聚一支, 其中武陵的YYH15117、YYH15118、YYH15119、YYH15120和YYH15121聚为一支, 这与Structure结构分析的结果一致。PCA结果表明, PC1和PC2的贡献率分别是62.2%和21.65% (图1C, 图中每个个体都用单独的圆表示, 不同颜色的圆代表不同的集群)。28份荷叶铁线蕨聚成明显的2组, 第一主成分PC1将武陵居群和余下5个居群分开, 与群体结构分析的结果一致, 群体间存在少数个体混杂现象, 说明所选群体之间存在基因交流, 与系统发育树结果相同。
2.5 群体大小历史分析
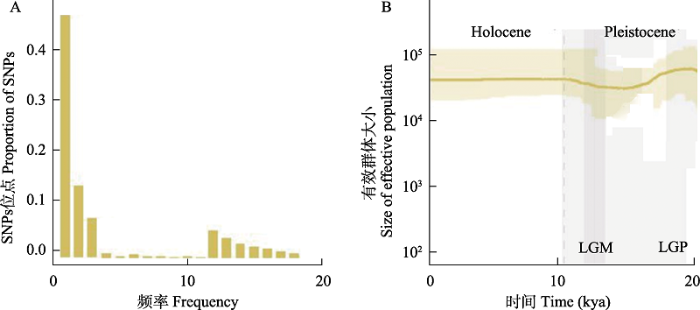
在Stairway Plot中对荷叶铁线蕨的群体大小随时间的变化进行推测。首先筛选不连锁的SNP数量9,423个, 依据图2A, Stairway Plot推测该种群100 kya至1 kya的有效群体大小变化(图2B)。如图所示, 荷叶铁线蕨115 kya至11.7 kya的末次冰期(last glacial period, LGP)经历种群收缩, 在11.2 kya的末次盛冰期(LGM)前经历种群扩张。这可能与冰期来临后, 荷叶铁线蕨对寒冷环境的极度不适应有关。在经历了长期的瓶颈效应后, 在15 kya左右, 种群才开始有轻微的扩张, 这可能是由于末次冰期结束后, 地球表面温度开始回升, 有利于荷叶铁线蕨的繁殖生长。
图2
图2
荷叶铁线蕨有效群体大小变化分析。A: 位点频谱; B: Stairway Plot基于SFS的群体大小变化。粗线为中位数, 阴影部分为95%置信区间。LGM: 末次盛冰期; LGP: 末次冰期。
Fig. 2
Changes in population size of Adiantum nelumboides. A, Folded site frequency spectrum (SFS); B, Changes in population size inferred by Stairway plot using folded site frequency spectrum (SFS). Thick lines represent the median, and shaded areas represent the 95% confidence intervals. LGM, Last glacial maximum; LGP, Last glacial period.
2.6 不同情景下潜在地理分布格局
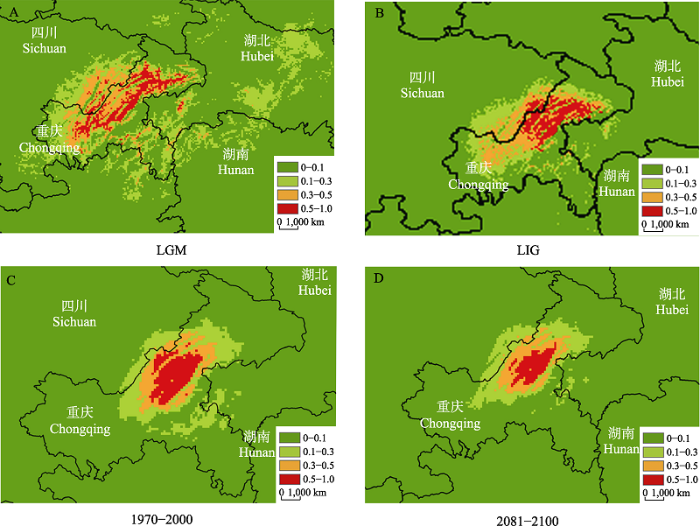
根据主导气候因子贡献率(附录2)可知, 现代气候情况下对荷叶铁线蕨地理分布影响较大的气候因子为昼夜温差月均值(42.4.%)和最冷季降水量(20.9%), 累计贡献率达63.3%。从各主导因子的变异范围看, 荷叶铁线蕨适宜生境的气候因子变异范围极为狭窄, 表明其对气候要求极为严格。现代气候条件下, 荷叶铁线蕨潜在分布区与现存分布较为吻合(图3), 适生区域分布比较局限, 核心区位于重庆的万州至石柱县, 在中国的适生总面积为2.79 × 104 km2, 中适生区主要分布于石柱县和丰都县, 面积为0.66 × 104 km2; 低适生区主要分布于武陵县、南川区和长寿区等, 面积为1.62 × 104 km2。
图3
图3
不同时期荷叶铁线蕨适宜性生境分布。A: 末次盛冰期气候情景; B: 末次间冰期气候情景; C: 现代(1970‒2000)气候情景; D: 未来(2081‒2100) RCP2.6气候情景。
Fig. 3
Distribution of suitable habitats for Adiantum nelumboides in different periods. A, Last glacial maximum climate scenarios; B, Last interglacial climate scenarios; C, Contemporary (1970‒2000) climate scenarios; D, Future (2081‒2100) RCP2.6 climate scenarios.
在2080年RCP2.6温室气体排放情景下, 荷叶铁线蕨总适宜分布面积呈增加趋势, 总适生区面积为2.82 × 104 km2。但与现代相比, 荷叶铁线蕨潜在的高适生区面积呈收缩趋势(仍主要分布于重庆万州区一带), 减少为0.36 km2, 减少了30.7%。中适生区面积基本不变。随着生境破碎化严重, 大量的高适生区将会丧失并转化为中适生区。未来气候情景下, 其适宜区向西北和西南方向迁移, 新获得的生境主要集中在重庆市西部和四川省东部。荷叶铁线蕨在末次盛冰期的潜在分布存在一定差异。推断的末次盛冰期潜在分布偏北, 且分布范围更为广泛, 总适生区面积为11.45 × 104 km2, 在湖北、湖南、贵州、四川均有分布。在末次冰期的总适生区面积为6.02 × 104 km2, 是现代气候条件下适生面积的2.15倍, 高适生区向北迁移。
3 讨论
3.1 荷叶铁线蕨遗传多样性
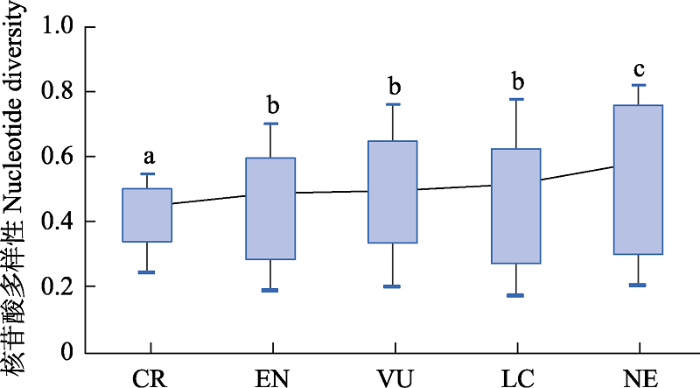
遗传多样性评估是濒危物种保育的基础。濒危或分布狭窄的物种的一个普遍特征就是遗传多样性水平较低(Gitzendanner & Soltis, 2000)。本研究利用SNP分子标记对荷叶铁线蕨6个自然居群进行分析, 结果显示均具有较低的遗传多样性(Ho = 0.138、He = 0.232、Pi = 0.373)。类似的结果也出现在濒危植物水蕨(Ceratopteris thalictroides) (Dong, 2007)、中华水韭(Isoetes sinensis) (陈进明等, 2004)与银杉(Cathaya argyrophylla) (冉巧等, 2019)中。杂合度(H)是目前应用较广泛的遗传多样性参数(Wang et al, 2017)。荷叶铁线蕨平均观测杂合度(0.138)小于平均期望杂合度(0.232), 各居群平均近交系数为0.143, 相比于水杉(Metasequoia glyptostroboides) (0.528, 苏金源等, 2020)、台湾油杉(Keteleeria formcsana Hayata) (0.85, 李江伟等, 2014)、丹霞梧桐(Firmiana danxiaensis) (0.536, 廖坤富等, 2021)和珊瑚菜(Glehnia littoralis) (0.508, 李玲丽等, 2021)等极危植物, 呈现出相对低程度的杂合, 居群内存在不同程度的杂合子缺失、近交衰退现象。为评估荷叶铁线蕨的濒危等级是否可准确反映其当前遗传多样性水平, 分析了各物种核苷酸多态性与其在IUCN红色名录中的濒危等级的相关性(图3), 结果表明, 随着物种濒危程度的增加, 其遗传多样性降低, 各物种遗传多样性水平符合其濒危等级(附录4)。Godt和Hamrick (1991)认为居群遗传变异大小的主要影响因素依次为繁育系统、分布范围和生活型, 并认为地方特有种或狭域分布的种具有较低的遗传多样性。因此导致荷叶铁线蕨遗传多样性较低的原因可能是其对生存和繁衍条件要求较为苛刻, 常生长在空气和土壤湿度较高而排水良好的陡峭崖壁中, 喜酸性土壤, 这使得荷叶铁线蕨物分布区域狭窄, 居群规模小, 从而引起近交衰退, 致使其遗传多样性丧失。
图4
图4
植物遗传多样性与濒危程度分析。CR: 极危; EN: 濒危; VU: 易危; LC: 无危; NE: 未予评估。图中数据来源于附录4参考文献。
Fig. 4
Genetic diversity and endangered degree. CR, Critically Endangered; EN, Endangered; VU, Vulnerable; LC, Least Concern; NE, Not Evaluated. Data in the figure were from the references listed in Appendix 4.
3.2 荷叶铁线蕨遗传结构与系统发育关系
遗传结构是一个物种最基本的特征之一, 受许多因素的影响, 包括生境片断化、繁育系统、基因流等(Ge et al, 2005)。荷叶铁线蕨主要有两种繁殖方式: 孢子繁殖和营养繁殖。但是荷叶铁线蕨孢子囊开裂较难且孢子成活率较低, 从萌发至形成幼孢子体需1年, 并且对生境要求严格, 其生长进程易受环境因素阻碍。因此, 理论上荷叶铁线蕨居群间基因流水平偏低。本研究结果证实, 与其他蕨类植物相比(Chen et al, 2004), 其居群内遗传变异较高(97.98%), 而居群间遗传分化较小。居群遗传结构的形成与基因流(Nm)密切相关, Hogbin和Peakall (1999)认为异交物种的遗传变异主要分布在居群内。因此, 荷叶铁线蕨应属于异交物种, 由于石壁阻挡, 从而形成狭域、小群体的特殊分布模式, 经几代无性繁殖后, 造成了遗传多样性较低的现状。
明确荷叶铁线蕨的遗传结构和系统发育关系是保护荷叶铁线蕨的背景和前提。荷叶铁线蕨的群体间特别是地理组群间也存在一定程度的遗传变异。本研究从28个荷叶铁线蕨的遗传结构分析可看出, 不同居群间的遗传距离与其地理分布有着密切关系, 基于Structure分析和PCA分析, 荷叶铁线蕨的6个自然居群可分为2个谱系, 均来自2种遗传分组。其中武陵居群和石柱居群都具有独有的遗传分组。群体之间并非完全独立, 存在着一定的基因渗透现象。因此, 初步推测荷叶铁线蕨群体历史分布区可能是连续的。
3.3 荷叶铁线蕨的群体历史和潜在分布格局
与现代气候相比, 在未来气候变化下濒危植物荷叶铁线蕨的潜在分布区面积略有增加, 其中高适生区面积减少, 中、低适生区面积显著增加。荷叶铁线蕨当前潜在适生区主要位于重庆市中部, 高适生区与实际现存野生种群分布区与三峡库区高度一致(余顺慧等, 2013)。未来气候变化情景下, 适生区呈扩张趋势, 昼夜温差月均值和最冷季降水量是影响荷叶铁线蕨潜在分布的主导气候因子。沈泽昊等(1999)根据荷叶铁线蕨仅自然分布于海拔430 m以下、且海拔300 m以上生长不佳的事实, 推测海拔高度引起的昼夜温差变化对其分布有重要影响, 本研究结果与这一推断一致。荷叶铁线蕨适宜分布区的气候因子变异极小, 表明其对气候的要求极为严格。另外, 环境因素(生物因素、非生物因素、微环境等)的变化也会影响物种的遗传多样性水平(李昂和葛颂, 2002)。由于三峡库区蓄水后水位上升导致低海拔的荷叶铁线蕨生境被淹没, 加之荷叶铁线蕨是一种形态独特的观赏植物及其药用价值被逐步了解, 当地居民随意采挖现象愈加严重。两种因素叠加导致荷叶铁线蕨居群的规模变得更小, 大多数地区仅发现几棵植株, 促使居群内近交现象越发严重, 可能因此导致种群的遗传多样性处于较低水平。本研究表明, 未来气候变化情景下荷叶铁线蕨适生区向西北迁移, 这可能与气候变暖条件下亚热带北界向北推移(Tingley et al, 2014)有很大的关联。
荷叶铁线蕨在中国境内的分布范围极其狭窄, 仅在重庆地区有发现, 野外资源非常稀少且人为采挖严重。如万州区长坪乡曾经有大量的分布, 但近年来栖息地逐渐减少, 野生资源也遭到严重采挖, 该地区已经极难发现野生居群。此外, 荷叶铁线蕨从孢子萌发到形成幼孢子体需要1年时间, 且孢子囊较难开裂, 这些特征都不利于其在野外的自我繁殖和资源更新。因此, 荷叶铁线蕨的野生资源亟待保护, 建议: (1)将武陵居群和其他居群作为两个保护单元加以保护, 同时要尽可能多地保护具有不同遗传分组的样本个体; (2)加强对当地居民的宣传工作, 减少人为破坏; (3)在开展就地保护的基础上通过建立种质资源苗圃、人工繁育等方式进行异地保护。
附录 Supplementary Material
附录1 荷叶铁线蕨简化基因组平均GC含量
Appendix 1 Average GC content of Adiantum nelumboides for genotyping by sequencing (GBS) reduced-representation genome sequencing
附录2 模拟荷叶铁线蕨潜在适宜分布的主要气候因子及其贡献率
Appendix 2 Main climatic factors used for simulating suitable area of Adiantum nelumboides and their contribution rate
附录3 不同气候变化情景下荷叶铁线蕨植物适生区面积及其占比的动态变化
Appendix 3 Dynamics of changes in suitable habitat area of Adiantum nelumboides under different climate scenarios
附录4 图4中植物遗传多样性数据来源文献
Appendix 4 References of plant genetic diversity data in Fig. 4
参考文献
RAPD analysis for genetic diversity of Isoetes sinensis
DOI:10.17520/biods.2004042 URL [本文引用: 2]
中华水韭遗传多样性的RAPD分析
DOI:10.17520/biods.2004042
[本文引用: 2]

采用RAPD方法对珍稀濒危植物中华水韭(Isoetes sinensis)4个自然居群的48个样品进行了DNA多态性分析。从60个随机引物中筛选出14个有效引物,共产生124条DNA片段,其中72条为多态性条带,总的多态位点百分率(PPB)为58.06%。各居群间多态位点百分率差异显著(0.81%–12.90%)。AMOVA分析结果表明,4个居群间基因分化系数 Φ<sub>st</sub>=0.5894,即遗传变异中有相当一部分来源于群体间(58.94%)。日益缩小的种群规模而导致的居群内近交和遗传漂变的发生以及居群间有限的基因交流可能是中华水韭目前遗传结构的主要成因。鉴于目前中华水韭居群内个体数偏少、遗传多样性较低的现状,建议对其进行就地保护并保护尽可能多的生境,对不同自然居群内的个体进行植株相互移栽和育苗移栽,以提高不同居群间的基因交流,尽可能地保护中华水韭的遗传多样性。
Research progress on the national rare and endangered medicinal plant of Adiantum reniforme L. var. sinence in the Three Gorges Reservoir Region
三峡库区国家珍稀濒危药用植物荷叶铁线蕨研究进展
Genetic structure in peripheral Western European populations of the endangered species Cochlearia pyrenaica (Brassicaceae)
DOI:10.1007/s00606-011-0500-9 URL [本文引用: 1]
The effect of Quaternary climatic changes on plant distribution and evolution
DOI:10.1016/S1360-1385(98)01327-2 URL [本文引用: 2]
Red list assessment of lycophytes and ferns in China
DOI:10.17520/biods.2016204 URL
中国石松类和蕨类植物的红色名录评估
为了解中国现存石松类和蕨类植物的灭绝风险, 我们按照IUCN Red List Categories and Criteria (Version 3.1)首次开展了国家水平上的红色名录评估。三人评估小组通过查阅文献、标本以及向其他30位中国蕨类同行征询物种信息等途径, 历经16个月的时间完成了此次评估。经统计, 中国目前所知的石松类和蕨类植物共计2,244种(包括亚种和变种, 但不包括变型和杂交种)。评估结果为: 极危(CR) 43种(其中6种可能已经灭绝)、濒危(EN) 68种、易危(VU) 71种、近危(NT) 66种、无危(LC) 1,124种、数据缺乏(DD) 872种。受威胁种类(包括VU、EN、CR)共计182种, 其中79种为中国特有或准特有种。特有而又极度濒危的植物有24种, 分别是梅山铁线蕨(Adiantum meishanianum)、荷叶铁线蕨(A. nelumboides)、秦氏莲座蕨(Angiopteris chingii)、壮乡铁角蕨(Asplenium cornutissimum)、海南实蕨(Bolbitis hainanensis)、直叶金发石杉(Huperzia quasipolytrichoides var. rectifolia)、东方水韭(Isoëtes orientalis)、台湾水韭(I. taiwanensis)、云贵水韭(I. yunguiensis)、台湾曲轴蕨(Paesia taiwanensis)、海南金星蕨(Parathelypteris subimmersa)、基羽鞭叶耳蕨(Polystichum basipinnatum)、洞生耳蕨(P. cavernicola)、微小耳蕨(P. minutissimum)、倒披针耳蕨(P. oblanceolatum)、岩穴耳蕨(P. speluncicola)、长柄新月蕨(Pronephrium longipetiolatum)、尾羽假毛蕨(Pseudocyclosorus caudipinnus)、罗浮牙蕨(Pteridrys lofouensis)、细叶凤尾蕨(Pteris angustipinna)、十字假瘤蕨(Selliguea cruciformis)、黑柄叉蕨(Tectaria ebenina)、河口叉蕨(T. hekouensis)和冈本氏岩蕨(Woodsia okamotoi), 它们应予以最优先保护。目前的红色名录只是一个初步评估结果, 若要得到一份更完整更准确的红色名录, 我们还需要做进一步的信息收集和评估工作, 特别要加强中国石松类和蕨类植物的分类学研究。今后评估工作中应重点关注的类群主要有莲座蕨属(Angiopteris)、铁角蕨属(Asplenium)、蹄盖蕨属(Athyrium)、对囊蕨属(Deparia)、鳞毛蕨属(Dryopteris)、石杉属(Huperzia)、耳蕨属(Polystichum)、凤尾蕨属(Pteris)、卷柏属(Selaginella)、水龙骨科(Polypodiaceae)和金星蕨科(Thelypteridaceae), 这些类群的物种分布与生存信息目前最为缺乏。
China Plant Red Data Book (Vol. 1):Rare and Endangered Plants
Genetic diversity analysis of yellow mustard (Sinapis alba L.) germplasm based on genotyping by sequencing
DOI:10.1007/s10722-013-0058-1 URL [本文引用: 1]
Strong genetic differentiation of the East-Himalayan Megacodon stylophorus (Gentianaceae) detected by inter-simple sequence repeats (ISSR)
Patterns of genetic variation in rare and widespread plant congeners
Rare species are typically considered to maintain low levels of genetic variation, and this view has been supported by several reviews of large numbers of isozyme studies. Although these reviews have provided valuable data on levels of variability in plant species in general, and rare species in particular, these broad overviews involve comparisons that may confound the effects of rarity with a multitude of other factors that affect genetic variability. Additionally, the statistical analyses employed assume the data to be independent, which is not the case for organisms that share a common phylogenetic history. As the role of evolutionary history and historical constraints has become better understood, more researchers have studied widespread congeners when investigating the genetic diversity of rare species in an effort to control for these effects. We summarize the available data from such studies, comparing for rare and widespread congeners (1) the levels of genetic variability at the population and species levels and (2) measures of population substructuring. At the population level, we summarized data for percentage polymorphic loci (%P(pop)), mean number of alleles per locus (A(pop)), and observed heterozygosity (H(o)). Species-level measures used were percentage polymorphic loci (%P(spp)), mean number of alleles per locus (A(spp)), and total genetic diversity (H(T)). Indices of population subdivision (either F(ST) or G(ST)) were also examined. Using Wilcoxon signed rank tests, we found significant, but small, differences between rare and widespread species for all diversity measures except H(T). However, there does not appear to be a difference between rare and widespread congeners in terms of how genetic variation is partitioned within and among populations. Levels of diversity, for all measures examined, between rare and widespread congeners are highly correlated.
Genetic variation in Lathyrus latifolius (Leguminosae)
DOI:10.1002/j.1537-2197.1991.tb11409.x URL [本文引用: 1]
The genetic legacy of the Quaternary ice ages
DOI:10.1038/35016000 URL [本文引用: 2]
Evaluation of the contribution of genetic research to the management of the endangered plant Zieria prostrata
DOI:10.1046/j.1523-1739.1999.98182.x URL [本文引用: 1]
A test of the glacial refugium hypothesis using patterns of mitochondrial and nuclear DNA sequence variation in rock ptarmigan(Lagopus mutus)
DOI:10.1111/j.1558-5646.1999.tb04574.x
PMID:28565471
[本文引用: 1]

The glacial refugium hypothesis (GRH) proposes that glaciers promoted differentiation and generation of intraspecific diversity by isolating populations in ice-free refugia. We tested three predictions of this hypothesis for the evolutionary divergence of rock ptarmigan (Lagopus mutus) during the Wisconsin glaciation of the late Pleistocene. To do this, we examined subspecies distributions, population genetic structure, and phylogenetic relationships in 26 populations across North America and the Bering Sea region. First, we analyzed sequence variation in the mitochondrial control region, in a nuclear intron (Gapdh), and in an internal transcribed spacer (ITS1). Control region sequences of 154 rock ptarmigan revealed strong population and phylogeographic structure. Variation in intron sequences of 114 rock ptarmigan also revealed significant population structure compatible with results for the control region. Rock ptarmigan were invariant for ITS1. Second, we show that five known Nearctic refugia and an Icelandic refugium are concordant with the current distribution of morphologically distinct subspecies; five of these six refugia are geographically concordant with the distribution of closely related control region haplotypes. Third, our estimates of the time since phylogenetic lineages diverged predated the last glacial maximum for all but two lineages. In addition, all lines of evidence suggest that two unknown refugia in the Bering Sea region supported rock ptarmigan during the Wisconsin glaciation. Overall, our results are most consistent with the hypothesis that isolated populations of rock ptarmigan diverged in multiple refugia during the Wisconsin and that geographic variation reflects patterns of recolonization of the Nearctic after the ice receded. The GRH may therefore offer the most plausible explanation for similar biogeographic patterns in a variety of Nearctic vertebrates.© 1999 The Society for the Study of Evolution.
The research progress of endangered causes and protection strategy of rare and endangered plants in China
中国珍稀植物濒危原因及保护对策研究进展
Ecological implications of genetic variation in plant populations
IUCN Red List of Threatened Species
http://www.iucnredlist.org. (accessed on 2021-11-18)
Advances in plant conservation genetics
DOI:10.17520/biods.2002009 URL [本文引用: 1]
植物保护遗传学研究进展
DOI:10.17520/biods.2002009
[本文引用: 1]

保护遗传学是运用遗传学的原理和研究手段,以生物多样性尤其是遗传多样性的研究和保护为核心的一门新兴学科。近几十年来,遗传学研究在生物多样性保护的理论和实践中发挥着越来越重要的作用。本文简要回顾了保护遗传学的发展历史、研究方向和涉及的概念,着重介绍了植物保护遗传学研究所取得的一些进展,包括植物系统发育重建和保护单元的确定、遗传多样性与物种和群体适应性之间的关系、群体遗传结构与保护策略的制定以及植物遗传资源的鉴定和利用等方面的内容,并强调保护遗传学研究是未来生物多样性和保护生物学研究中一个亟待加强的研究领域。
Fast and accurate long-read alignment with Burrows-Wheeler transform
DOI:10.1093/bioinformatics/btp698 URL [本文引用: 1]
Genetic diversity of Taiwania cryptomerioides detected by ISSR analysis
台湾杉遗传多样性的ISSR分析
Analysis of SSR loci information in the transcriptome of Glehnia littoralis
珊瑚菜转录组的SSR位点信息分析
A study on plant diversity evaluation in Danxia Wutong Nature Reserve in Nanxiong City
广东南雄丹霞梧桐自然保护区植物多样性评价
The current study situation of Chinese biodiversity and its protective planning development
中国生物多样性及其保护规划发展研究现状
Biodiversity conservation and its research progress
生物多样性保护及其研究进展
Rapid and cost-effective polymorphism identification and genotyping using restriction site associated DNA (RAD) markers
DOI:10.1101/gr.5681207 URL [本文引用: 1]
Genetic diversity of the natural populations of Adiantum reniforme var. sinense
DOI:10.1360/biodiv.040117 URL [本文引用: 1]
荷叶铁线蕨自然居群的遗传多样性研究
DOI:10.1360/biodiv.040117
[本文引用: 1]

荷叶铁线蕨(Adiantum reniforme var.sinense)为我国特有植物,具有重要的经济价值,目前仅分布于重庆的少数地区。近几十年来,由于过度开发,该种的分布范围日益缩小,已处于灭绝的边缘。本研究利用等位酶标记检测了荷叶铁线蕨 6个自然居群共136个个体的遗传多样性,共检测到了5个酶系统的14个位点,获得了7个多态位点。结果表明:与其他蕨类植物相比,荷叶铁线蕨居群内的遗传多样性水平比较低。平均每位点的有效等位基因数(A<sub>e</sub>)为1.778,多态位点百分率(P)为0.441,期望杂合度(H<sub>e</sub>)为0.199,观察杂合度(H<sub>o</sub>)为0.235。其居群间的遗传分化也很低,居群间的遗传变异仅占总变异的1.49%,而98.51%的变异存在于居群内部。采用Hardy-Weinberg平衡和固定指数F对荷叶铁线蕨的居群遗传结构进行了分析,结果表明其种群可能是以配子体间异交为主的混合交配体系。导致荷叶铁线蕨濒危的主要原因是生境的破坏以及过度开采所导致的生境片断化使其居群变小、近交率加大、遗传变异趋低,降低了其生存以及进化的潜力。
De novo sequencing of sunflower genome for SNP discovery using RAD (Restriction site Associated DNA) approach
DOI:10.1186/1471-2164-14-556 URL [本文引用: 1]
Impact of climate change on the potential distribution and habitat fragmentation of the relict plant Cathaya argyrophylla Chun et Kuang
气候变化对孑遗植物银杉的潜在分布及生境破碎度的影响
An contrast on the characteristics of soil in the natural habitat and resite reserve of two endemic species of the Three Gorges reservoir region of Yangzi River
三峡库区两种特有植物天然生境与迁地生境土壤特征的比较
Genetic diversity and population structure of Ethiopian Capsicum germplasms
DOI:10.1371/journal.pone.0216886 URL [本文引用: 1]
Informing conservation strategies with genetic diversity in Wild Plant with Extremely Small Populations: A review on gymnosperms
DOI:10.17520/biods.2019116 URL [本文引用: 1]
通过遗传多样性探讨极小种群野生植物的致濒机理及保护策略: 以裸子植物为例
DOI:10.17520/biods.2019116
[本文引用: 1]

遗传多样性是生物多样性的重要组成部分, 然而由于资源的过度开发利用和生境的破碎化影响了物种的遗传多样性, 甚至威胁到物种的生存适应性和生物多样性。极小种群野生植物是亟待保护的国家重点保护濒危植物,遗传多样性研究对揭示极小种群致濒机理及保护策略具有重要意义。生境破碎化会造成物种遗传多样性降低、种群间分化增加、基因流减少等, 使种群濒危。但在某些物种中, 繁殖特征、进化历史等生物和生态因素的不同也可能造成近期生境破碎化后遗传效应的延迟。裸子植物进化历史悠久, 包含许多孑遗物种, 由于生活史周期长, 遭受生境破碎化后可能短期内显示不出遗传效应的改变, 但长期很难恢复。本文以裸子植物为例综述了濒危植物的遗传多样性研究的案例, 探讨了濒危裸子植物应对环境恶化的维持机制、致濒因素和保护方案, 旨在说明通过遗传多样性研究充分认识极小种群致濒机理对高效保护极小种群野生植物的重要性。
Identifying long-term stable refugia for relict plant species in East Asia
DOI:10.1038/s41467-018-06837-3 URL [本文引用: 1]
Realized niche shift during a global biological invasion
Identification of the relationship between Chinese Adiantum reniforme var. sinense and canary Adiantum reniforme
DOI:10.1186/s12870-014-0361-9 URL [本文引用: 1]
The complete chloroplast genome of the endangered Chinese paperbark maple
Three-Gorges Dam-Experiment in habitat fragmentation
DOI:10.1126/science.1083312 URL [本文引用: 1]
Study on accompanying vascular plants of Adiantum reniforme var. sinense community in Three Gorges Reservoir area
三峡库区珍稀濒危植物荷叶铁线蕨群落伴生维管植物研究