

|
|
||
|
植物开花时间的遗传调控通路研究进展
生物多样性
2021, 29 (6):
825-842.
DOI: 10.17520/biods.2020370
开花时间对植物的繁殖成功至关重要。广泛分布的物种经常发生开花时间的分化, 从而能够更好地适应不同的环境条件。为了探索植物开花行为发生适应性分化的分子机制, 首先要明确调控开花行为的遗传通路。本文梳理了植物各类群调控开花时间的遗传通路, 以期为开花时间适应性分化的分子机制研究提供依据。 植物从营养生长向繁殖转变时, 其开花行为主要受到光照、温度、水分等外界环境因子和赤霉素等内在因素的影响。通过对模式植物拟南芥(Arabidopsis thaliana)和其他类群的研究, 总结出了调控植物开花时间的6条通路, 包括日照长度和光质影响开花的光依赖通路, 长时间冷暴露后促进植物开花的春化通路, 高温或低温环境影响开花的温度通路, 以及赤霉素通路、年龄通路和自主通路3条内部调节过程。植物开花时间调控的6条上游通路信号传递到下游的开花整合基因FT(FLOWERING LOCUS T)和SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1), 整合基因将这些复杂的调节因子整合后进一步传递到下游花分生组织, 从而启动开花。此外, 非编码RNA、转座子对开花时间的调控也具有重要作用。部分遗传通路被证实在植物适应环境的过程中起到了重要作用。目前对植物开花调控的研究已经有一百多年历史, 理论相对成熟。然而, 仍然存在许多具有争议和未解决的问题, 如开花基因的表达方式、开花行为的特殊调控机制、开花时间变异的适应性意义等等, 需要更进一步的研究。 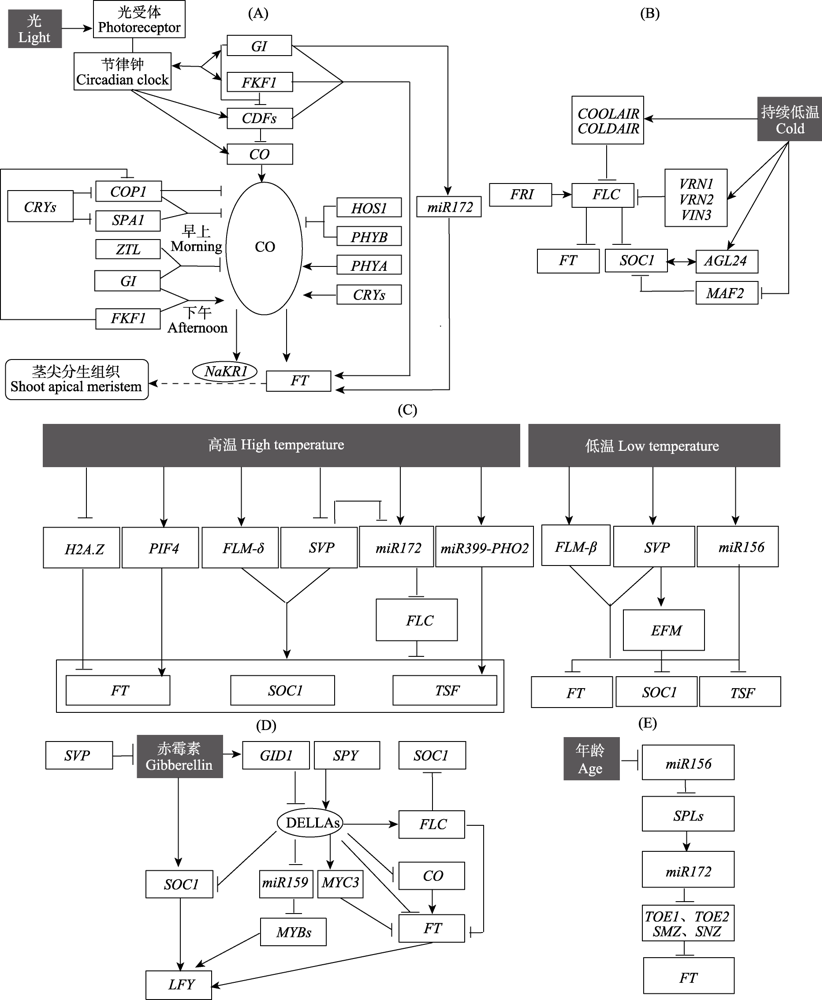 View image in article
图2
拟南芥开花调控各通路的详细图解。(A)光周期通路; (B)春化通路; (C)温度通路; (D)赤霉素通路; (E)年龄通路。黑色填充方框代表外界调节因子。方框内的字母代表基因的简称, 椭圆框内的字母代表蛋白的简称。带箭头实线代表促进作用, 平端实线代表抑制作用。双向箭头代表相互作用。在图(A)中, 圆角矩形框指开花素转运到的位置, 带箭头的虚线代表转运过程。
正文中引用本图/表的段落
CO(CONSTANS)是光周期路径的关键下游基因。在长日照下CO的表达被三种蛋白的活性修饰: GI、FKF1、CDF1(CYCLING DOF FACTOR 1) (Imaizumi et al, 2005; Sawa et al, 2007; Fornara et al, 2009)。这三个基因本身受昼夜节律钟的调控。CDFs属于转录调节因子家族, 通过直接与CO调节区域结合作为CO转录的抑制因子(Fornara et al, 2009)。在昼夜节律钟的调控下, CDFs、GI和FKF1先后表达, FKF1与抑制CO转录的CDF1-GI复合物相互作用, 并通过其F-Box结构域使CDF1降解(Sawa et al, 2007), 一旦CDF被降解, FBHs(FLOWERING BHLHs)和TCPs(TEOSINTE BRANCHED/CYCLOIDEA/PROLIFERATING CELL NUCLEAR ANTIGEN FACTORs)将诱导CO的转录(Ito et al, 2012; Kubota et al, 2017)。CO不仅在转录水平上受到调控, 其蛋白质稳定性和积累水平也受到调控(图2A)。晚上, COP1-SPA1(CONSTITUTIVE PHOTOMORPHOGENIC 1-SUPPRESSOR OF PHYA 1)复合物降解CO蛋白, 以抑制在短日照下的开花(Jang et al, 2008)。而存在蓝光时, 蓝光受体CRY2与COP1-SPA1复合物结合能够抑制对CO蛋白的降解作用(Zuo et al, 2011)。除此之外, 还有依赖ZTL/FKF1的调节机制, 早上, ZTL可能与GI一起降低CO的稳定性(Song et al, 2014); 下午, FKF1通过抑制功能性COP1的同源二聚化来增加CO蛋白(Lee et al, 2017)。由于GI也与CO直接相互作用, FKF1、GI和CO可能形成三聚体复合物并稳定CO(Song et al, 2014)。除了与光周期相关的调节外, CO蛋白的积累还受到光受体的影响。红光受体PHYB在早上与HOS1 (HIGH EXPRESSION OF OSMOTICALLY RESPONSIVE GENES 1)形成复合物抑制CO蛋白的积累(Lazaro et al, 2015); 远红光受体PHYA促进CO蛋白的积累(Valverde et al, 2004); CRY2感知蓝光并稳定CO(Zuo et al, 2011)。最终使得长日照下CO在黎明和下午表达, 进而使得FT转录水平上调并诱导开花; 而短日照下, 高水平的CO表达在黑暗中发生, 不会上调FT, 从而导致开花延迟(Putterill et al, 2004)。CO还能诱导与FT转运相关的NaKR1(SODIUM POTASSIUM ROOT DEFECTIVE 1)的表达, 从而促进FT向茎尖分生组织转运, 最终诱导花芽的形成(Shim et al, 2017)。在光周期通路中, 除了通过CO途径影响下游基因外, GI也能通过miR172间接激活FT, 或通过与FT启动子结合并与FT抑制因子形成复合物来直接激活FT, 从而促进开花(Sawa & Kay, 2011)。最近有研究鉴定到两种新的FT转录增强子Block E和Block C, 它们能够影响FT表达对光周期的响应(Zicola et al, 2019)。
春化作用能够降低FLC mRNA水平以促进开花(Sheldon et al, 2000)。在温度升高后, FLC mRNA依然保持低水平, 但减数分裂后FLC mRNA重新分配回到正常值(Simpson & Dean, 2002), 因此这种春化状态不能由亲本传给子代。FLC的转录激活因子对于在春化植物胚胎中重新激活FLC的表达很重要, 确保幼苗不受亲本春化作用的影响(Yun et al, 2011)。在拟南芥中鉴定出了3个FLC的调节因子: VRN1(VERNALISATION 1)、VRN2以及VIN3(VERNALISATION INSENSITIVE 3), 它们都是FLC的负调节因子。有研究表明FLC在响应春化时是表观沉默的。在寒冷时, VRN1和VRN2维持FLC的沉默 (Gendall et al, 2001);而VIN3抑制FLC的表达, VIN3在寒冷时能够被瞬间诱导产生(Sung & Amasino, 2004)。另外还发现非编码RNA是一类新的基因表达调控因子, 也能够调节FLC。例如在拟南芥中的COOLAIR(COLD INDUCED LONG ANTISENSE INTRAGENIC RNA)和COLDAIR(COLD ASSISTED INTRONIC NONCODING RNA): 在寒冷条件下, COOLAIR在VIN3发挥作用之前先转录, 抑制FLC的转录(Swiezewski et al, 2009); COLDAIR在FLC被抑制时激活, 进一步抑制FLC(Heo & Sung, 2011)。有研究发现, 许多与FLC相关的转录因子如MAF1-5 (MADS AFFECTING FLOWERING 1-5)和AGL24(AGAMOUS-LIKE 24)在春化反应中受到的调控独立于FLC, 这些基因可能在调节春化反应中起着重要的作用(Alexandre & Hennig, 2008) (图2B)。如在青菜(Brassica rapavar. chinensis)中, BcMAF2能够直接与BcTEM1(青菜的TEMPRANILLO 1同源基因)结合并促进其表达, 从而抑制开花(Huang et al, 2019)。拟南芥在春化作用下, AGL24和SOC1能够上调彼此的表达, 以独立于FLC的方式介导春化促进开花(Michaels et al, 2003)。
除了春化作用外, 外界环境温度还直接影响开花行为。一般来说, 高环境温度促进开花, 而低环境温度延迟开花(Jagadish et al, 2016)。拟南芥在较高的环境温度下开花较早, 且在拟南芥的其他生活型中, 较高的温度可以作为诱导性长日照的替代, 比如PHYB突变体在23℃比在16℃时开花早(Halliday et al, 2003)。对拟南芥的研究发现, 不同温度下FLM(FLOWERING LOCUS M)的可变剪切体和SVP(SHORT VEGETATIVE PHASE)的稳定性影响了开花行为, 同时发现H2A.Z、PIF4(PHYTOCHROME INTERACTING FACTOR 4)、miR399-PHO2(microRNA399-PHOSPHATE 2)和miR172基因介导了高温对开花行为的影响, 而miR156则是低温下抑制开花的负调节因子(Verhage et al, 2014) (图2C)。FLM属于FLC家族, 在不同的环境温度下具有不同的可变剪切体(Balasubramanian et al, 2006)。其两个主要剪切体形成的蛋白通过与SVP相互作用而发挥拮抗作用, 在低温下产生的剪切体FLM-β是一种开花抑制因子, 而高温下产生的剪切体FLM-δ是开花的激活因子(Poséet al, 2013)。SVP蛋白在高温下不稳定。在较低温度下, 相对增加的SVP蛋白与FLM-β相互作用, 通过直接结合下游靶基因抑制开花。长日照下的寒冷夜晚条件下FT的表达会受到抑制, 导致开花延迟, 这主要是由于上述SVP-FLM-β复合物的增加所导致的(Kinmonth-Schultz et al, 2016)。FT、TSF(TWIN SISTER OF FT, FT的姊妹基因)和SOC1是开花行为对环境温度响应过程中SVP、FLM和FLC基因的主要下游靶点。SVP对FLC没有调节作用但它们可能协同作用。两者在时间和空间上表现出相似的表达, 在FT和SOC1上有共同的结合位点, 因此SVP可能以依赖FLC的方式调节这些基因的表达(Li et al, 2008)。MYB转录因子EFM(EARLY FLOWERING MYB PROTEIN)也介导环境温度对开花的影响, 直接抑制叶片维管中FT的表达。SVP和EFM主要在同一调控途径中起着抑制开花的作用。EFM介导SVP对温度响应通路下游的影响, 其表达受到SVP的上调从而抑制开花, 并通过H3K36me2去甲基酶JMJ30与光响应的昼夜节律钟相互作用(Yan et al, 2014)。在相对高温和短日照的环境下, 转录因子PIF4结合并激活FT, 另外对FT位点具有抑制性作用的H2A.Z核小体的富集率降低, 从而促进开花(Kumar et al, 2012)。此外, 拟南芥在较高温(23℃)和长日照条件下, miR399b的过度表达和其靶基因PHO2功能等位基因的缺失导致开花提前(Kim et al, 2011)。研究认为miR399-PHO2维持了磷稳态, 并通过增加TSF的表达来调节开花时间(Kim et al, 2011)。然而, 在miR399过量表达PHO2突变体植物中磷酸盐毒性的间接后果也可能导致早开花, 需要进一步研究(Spanudakis & Jackson, 2014)。温度也能够调节miR156和miR172的表达水平: 在较低温度(16℃)下, miR156的表达受到促进导致开花延迟, 在较高的温度(23℃)下, miR156表达受到抑制, 而miR172则相反(Lee et al, 2010; Kim et al, 2012)。温度对miR172的调控受到SVP的影响, SVP抑制miR172的表达, 而miR172则有可能通过抑制FLC来促进开花(Lee et al, 2010)。此外, 有研究发现ICA(ICARUS)编码转运RNA加工相关酶的基因, 其不同的基因型能够改变拟南芥开花时间对温度的响应行为(Méndez-Vigoet al, 2019)。
赤霉素是调节植物休眠、萌发、茎伸长和开花等发育过程的植物激素。它不仅能刺激植物器官的生长, 还能诱导发育阶段的转变(Mutasa-G?ttgens & Hedden,2009)。赤霉素在某些植物(如拟南芥)中促进开花, 而在其他植物(如苹果Malus × domestica)中抑制开花, 因此赤霉素对于不同植物的作用具有差异性(Zhang SW et al, 2019)。拟南芥中, 在短日照条件下, 赤霉素促进开花作用最强(Porri et al, 2012)。在叶中, 赤霉素信号被GID1(GA INSENSITIVE DWARF 1)感知, GID1经历构象变化后使赤霉素与DELLA(Asp-Glu-Leu-Leu-Ala)蛋白相互作用, 赤霉素启动DELLA蛋白的降解从而促进开花(Sun, 2010) (图2D)。SPY(SPINDLY)蛋白作为赤霉素信号转导的抑制因子, 可能通过岩藻醣基化上调DELLAs蛋白来延迟开花(Jacobsen et al, 1998; Zentella et al, 2017)。DELLA蛋白能直接与CO结合从而下调FT(Wang et al, 2016; Xu F et al, 2016), 还能够与PIF4相互作用而抑制FT的表达(de Lucas et al, 2008)。除此之外, DELLA蛋白还能够与FT的抑制因子相互作用来抑制FT的表达, 如MYC3与DELLA蛋白相互作用直接抑制FT(Bao et al, 2019)。另外, DELLA蛋白很可能与富集PRC2(POLYCOM REPRESSIVE COMPLEX 2)的PKL(PICKLE)相互作用, PRC2会提高FLC中的组蛋白标记H3K27me3的水平, 使得FLC沉默, 从而调节FT和SOC1等靶基因, 进而调控开花行为(Li et al, 2016; Campos-Rivero et al, 2017)。赤霉素还会通过抑制DELLA蛋白对miR159产生影响, 随后影响miR159的靶序列MYB, 最终影响LFY(LEAFY)的表达(Achard et al, 2004)。除了通过DELLA蛋白的作用, 赤霉素还能够通过影响赤霉素的生物合成和运输来调控开花, 主要与赤霉素氧化酶有关, 它们能够将赤霉素前体转化为赤霉素活性物质, 进而促进开花(Mitchum et al, 2006)。另一方面, 赤霉素通过促进SOC1诱导基因(如AGL24)的表达、下调植物开花抑制因子(如SVP)等多个途径来调节SOC1的表达, 影响LFY的表达进而影响开花(Li et al, 2008)。有研究发现SVP能够抑制赤霉素的合成酶GA20ox2(GIBBERELLIN 20 OXIDASE 2), 导致赤霉素含量降低, 从而抑制开花(Andréset al, 2014)。
年龄通路为内源的开花调节通路, 主要由miR156-SPL(SQUAMOSA PROMOTER-BINDING PROTEIN-LIKE)和miR172-AP2(APETALA 2)调节(Hyun et al, 2017)。miR156抑制SPL, 它能调节营养阶段的生长, 受到糖有关的信号分子影响, 其表达随着植物年龄的增长而减少, 使得SPLs表达增加, 促进植物开花并向成熟期过渡(He et al, 2018)。在拟南芥中, SPL基因可分为两大类, 其中miR156识别的有与开花相关的SPL2、SPL9、SPL10、SPL11、SPL13和SPL15, 以及促进花分生组织分化的SPL3、SPL4和SPL5(Hyun et al, 2016; Xu ML et al, 2016)。SPL9和SPL15结合miR172b基因的启动子促进其表达, 再通过抑制开花抑制基因AP2-like的表达促进开花, AP2-like基因TOE1(TARGET OF EARLY ACTIVATION TAGGED 1)、TOE2、SNZ(SCHNARCHZAPFEN)、SMZ(SCHLAFMUTZE)都被证明是开花抑制因子, 它们抑制FT的表达(Mathieu et al, 2009; Zhu & Helliwell, 2011; Song et al, 2013) (图2E)。
对植物开花时间调控的研究多集中于模式植物拟南芥.但是拟南芥是一种长日照植物, 而光周期对于开花具有很强的影响, 所以需要研究短日照植物和日中性植物开花的调控过程, 并分析开花调控通路的保守性和差别性.目前对其他植物研究最多的是水稻(Oryza sativa)、荠菜(Capsella rubella)、豌豆(Pisum sativum)、烟草(Nicotiana tabacum)、番茄(Solanum lycopersicum)等.经研究发现, 水稻作为短日照植物的代表, 有许多与拟南芥功能相同的开花相关基因.其他植物也具有许多与拟南芥同源的开花基因, 证明了从拟南芥中发现的开花通路具有显著的保守性; 但是其他植物也有自己独特的开花调控基因, 说明了开花时间调控具有物种差异性.本文将以拟南芥为代表综述主要的6个开花时间调控通路和相应的开花时间调控基因, 并总结其他植物在开花调控通路上的研究进展, 比较其在物种间的保守性和差异性, 阐述此类研究中仍然存在的争议和问题.... Molecular basis of natural variation in photoperiodic flowering responses 1 2019 ... 赤霉素是调节植物休眠、萌发、茎伸长和开花等发育过程的植物激素.它不仅能刺激植物器官的生长, 还能诱导发育阶段的转变(Mutasa-G?ttgens & Hedden, Plant reproductive systems and evolution during biological invasion 1 2008 ... 开花是决定植物繁殖成功的重要过程, 植物必须准确地将内部信号和环境信号相结合然后启动开花过程.最优的开花时间对于植物适合度收益的最大化有着非常重要的影响, 在错误的时间开花可能会使植物开花时间与传粉环境不匹配, 导致不能够成功传粉, 从而产生更大的适合度代价(Kitamoto et al, Differential interactions of the autonomous pathway RRM proteins and chromatin regulators in the silencing of Arabidopsis targets 1 2008 ... 除环境因素外, 植物的内部信号也参与调节开花.自主通路相关基因的突变体FCA(FLOWERING LOCUS CA)、FY(FLOWERING LOCUS Y)、FPA(FLOWERING LOCUS PA)、LD(LUMINIDEPENDENS)、FLD(FLOWERING LOCUS D)、FLK(FLOWERING LOCUS KH DOMAIN)和FVE(FLOWERING LOCUS VE)在长日照和短日照条件下开花都较晚(Simpson, Physiological signals that induce flowering 1 1993 ... 开花时间调控的研究已有100多年的历史(Kobayashi & Weigel, Activation of a floral homeotic gene in Arabidopsis 1 1999 ... 花分生组织基因的分子功能是DNA转录因子.上游的花整合基因传递到下游的花分生组织基因, 花分生组织基因在茎尖分生组织中上调, 从而诱导开花.如拟南芥中, FT和TSF基因从叶片传输到茎尖分生组织, 它们与FD形成一个复合物, 激活花分生组织基因(包括AP1和FUL)的过表达(Perrella et al, Plant hormone signaling in flowering: An epigenetic point of view 1 2017 ... 赤霉素是调节植物休眠、萌发、茎伸长和开花等发育过程的植物激素.它不仅能刺激植物器官的生长, 还能诱导发育阶段的转变(Mutasa-G?ttgens & Hedden, Research progress on the autonomous flowering time pathway in Arabidopsis 3 2017 ... 除环境因素外, 植物的内部信号也参与调节开花.自主通路相关基因的突变体FCA(FLOWERING LOCUS CA)、FY(FLOWERING LOCUS Y)、FPA(FLOWERING LOCUS PA)、LD(LUMINIDEPENDENS)、FLD(FLOWERING LOCUS D)、FLK(FLOWERING LOCUS KH DOMAIN)和FVE(FLOWERING LOCUS VE)在长日照和短日照条件下开花都较晚(Simpson,
本文的其它图/表
|