黄曲霉(Aspergillus flavus)作为一种腐生菌广泛分布于自然界的土壤、空气、水体和人类活动场所。该菌同时也是一种植物机会病原菌, 严重影响农作物产量和质量(Horn, 2003)。另外, 有些黄曲霉菌株还是人类和多种动物的机会病原菌, 约有15%的人类曲霉病(aspergillosis)由黄曲霉引起(Hedayati et al, 2007; Krishnan et al, 2009)。更具危害性的是它还产生强致癌剂黄曲霉毒素B (aflatoxin B, AFB), 严重威胁着世界粮食和饲料的安全。另外AFB可以在哺乳动物体内被羟基化分泌到乳汁当中称为AFM (aflatoxin M), 严重威胁着哺乳动物和人类的健康(CAST, 2003)。
黄曲霉在分类学上属于真菌界子囊菌门散囊菌纲散囊菌目曲霉科曲霉属(Aspergillus)黄曲组(Section Flavi)。典型黄曲霉的分类学性状是在25-37 ℃时生长迅速, 产生大量黄绿色分生孢; 分生孢子形状多为球形和近球形, 直径3.0-6.0 μm, 表面带刺; 通常产生深棕色至黑色菌核, 直径通常400-800 μm, 有些菌株的菌核小于350 μm, 通常产生真菌毒素AFB和圆弧偶氮酸(cyclopiazonic acid, CPA), 有极少菌株还产生黄曲霉毒素G (aflatoxin G, AFG) (Frisvad et al, 2019)。其菌株在菌核的产生与否、菌核大小和产毒与否及毒素种类上差别很大(Raper & Fennell, 1965)。Saito和Tsuruta (1993)在泰国发现了一些“不典型”的“黄曲霉”菌株, 这些菌株产生的菌核直径小于400 μm, 产生毒素AFB和CPA。这些“不典型”菌株被定为黄曲霉小核变种(A. flavus var. parvisclerotigenus Mich. Saito and Tsuruta)。Frisvad等(2005)在尼日利亚也发现了该类型菌株, 他们根据形态学、产毒特性和rDNA ITS1-5.8S-ITS2序列将其提升为独立的种, 即小核曲霉(A. parvisclerotigenus (Mich. Saito and Tsuruta) Frisvad and Samson)。但是他们选定的模式菌株不是在泰国的模式菌株A. flavus var. parvisclerotigenus CBS 121.62, 因此A. parvisclerotigenus为不合法名称。Frisvad等(2019)的研究认为A. flavus var. parvisclerotigenus应是A. flavus的一些产小核的特殊菌株, 而分离自尼日利亚的产小核及AFB和AFG的菌株则属于一个新种, 即黄毒曲霉(A. aflatoxiformans Frisvad, Ezekiel, Samson & Houbraken)。Cotty (1989)在美国发现了另外一些“不典型”的“黄曲霉”小核菌株, 将其称为S型菌株, 而将产大核的“典型”菌株称为L型菌株。前者产毒能力强, 后者产毒能力较弱或不产毒。S型菌株又包括2种类型: 第一类型菌株只产生AFB和CPA, 不产生AFG, 因此该类菌株应属于A. flavus; 第二类菌株除了产生AFB、AFG和CPA, 还产生大量的parasiticolides, 而A. flavus和A. aflatoxiformans不产生该种物质, 因此该类菌株很可能代表另外一个隐存种(cryptic species)。Geiser等(2000)根据3个基因amdS、omt12和trpC13片段序列(其中omt12是非直源基因(non-orthologous gene), 属于AF生物合成基因簇)对来自美国、澳大利亚和尼日利亚的33株黄曲霉和3株米曲霉(A. oryzae)进行了系统发育学分析, 将这些菌株分为2个群(Group I和Group II)。Group I包括产大核和小核菌株, 均不产生AFG。该群又由3个亚群组成: IA包括产大核和小核菌株, 多数产生AFB和CPA, 有些不产AFB; IB包括产大核菌株, 均不产生AFB和AFG, 但有些产生CPA, 有些不产CPA, 还包括部分米曲霉菌株; IC包括产大核菌株, 均不产AFG, 多数产AFB和CPA, 少数产AFB但不产CPA。Group II菌株产生AFB、AFG和CPA, 均由产小核菌株组成。Pildain等(2008)根据形态学、产毒特征、beta-tubulin (benA)和calmodulin (CaM)基因片段序列将Group II菌株定为一个新的隐存种, 即微核曲霉(A. minisclerotigenes)。至此, 黄曲霉广义种(A. flavus sensu lato)包括了3个种: 黄曲霉、黄毒曲霉和微核曲霉。而在东亚地区用于食品酿造的A. oryzae, Raper和Fennell (1965)的专著中将其作为A. flavus的一个近缘种, 后来的学者认为它是A. flavus的一个驯化类群, 应作为A. flavus的变种(Kurtzman et al, 1986)。Geiser等(2000)的研究显示A. oryzae属于A. flavus的一个群的亚群(见前述), 并建议保留A. oryzae的分类地位, Frisvad等(2019)的研究也沿袭了这种处理方法。
黄曲霉是一类适应能力很强的霉菌, 其生长温度范围相当广泛, 为10-48℃, 最适生长温度为33-37℃; 最适产毒温度也较宽, 为28-37℃, 而且在低水活度(water activity, aw)为0.73时也能正常生长和产毒(Pitt & Hocking, 2009)。气候和地理环境因素决定了其不同类群的分布。一般规律是在热带和高温干旱地区高产毒类群发生频率较高, 而在温带和较湿润的地区无毒类群占优势(Paterson & Lima, 2010)。比如在美国南部和阿根廷, 大部分为产毒较强的产小核的A. flavus, 其次为无毒群, 而且前者主要分布于高温干旱地区, 如亚利桑那沙漠(Cotty, 1997; Orum et al, 1997; Horn & Dorner, 1999; Barros et al, 2005)。A. flavus的产毒菌株通常分布于低纬度的热带及高温干旱地区, 但由于全球气候变化, 非季节性天气和极端天气如异常高温干旱天气逐渐增多, 受影响的地区和生物种类及自然生态系统在逐步扩大, 中高纬度地区和温带地区的植物、动物和人群正在受到高产毒黄曲霉的威胁(Hedayati et al, 2007; Krishnan et al, 2009; Paterson & Lima, 2010)。
我国地处北半球, 占国土总面积约70%的地区属于中温带、暖温带、亚热带, 这三个温度带集中了我国主要人口和粮食生产基地, 这些地区种植的正是黄曲霉类群容易侵染的作物, 如玉米、花生和棉籽。由于全球气候异常, 非季节性天气和极端天气增多, 我国大部分地区有可能受到高产毒黄曲霉类群的侵袭。有学者对我国部分地区的粮食中AFB污染情况进行了调查, 发现毒素污染在华南、华中和华东地区高, 华北较低, 东北和西北最低(高秀芬等, 2011)。我国浙江省只发现了产大核和AFB的A. flavus (Wang et al, 1993), 但汪汉成等(2014)发现烟草种子携带高产毒的A. minisclerotigenes。《中国曲霉志》(齐祖同等, 1997)记载的黄曲霉大部分来自亚热带地区。但是这些研究只是对我国部分省区的黄曲霉类群进行的调查, 而且有些研究中物种概念比较模糊。本研究系统调查了我国中温带、暖温带和亚热带以及青藏高原地区黄曲霉遗传多样性、产毒特征和地理环境分布, 进一步明确了黄曲霉的物质概念, 可为我国粮食安全的评估提供科学依据。
1 材料与方法
1.1 样品采集与菌株分离
土壤样品选择我国26省区的农田、荒野、林地、山地4种环境类型的土壤, 采集腐殖质-淋溶层土壤约20 g放入无菌自封塑料袋中。玉米、花生、棉籽等粮食样品到当地农户或粮食市场收集, 同样约20 g放入无菌自封塑料袋中。土壤样品分离采用Malloch (1981)的倍比稀释倾倒平皿法。在25-30℃培养到合适天数, 挑取单菌落接种于麦芽精(Malt Extract Agar, MEA)斜面, 25℃培养7 d后冷藏于4℃待鉴定(Pitt & Hocking, 2009)。粮食样品采用Andersen和Thrane (2006)的直接平皿法(direct plating), 挑选单菌落转接至MEA斜面, 25℃培养7 d后冷藏于4℃以待鉴定。
1.2 形态学鉴定
将菌株接种于MEA培养基, 于25℃培养7 d。进行培养性状和显微性状的观察, 按照Raper和Fennell (1965)、Frisvad等(2005)、Pildain等(2008)、Pitt和Hocking (2009)的方法鉴定到种。
1.3 AF和CPA的检测
在3 mL酵母精蔗糖(yeast extract sucrose, YES)液体培养基中接入约106个孢子, 每株菌3个重复分别于30℃、33℃、37℃倾斜45°角培养3 d。AFB和CPA的提取和检测参考Sepahvand等(2011)。
1.4 遗传多样性分析
所研究的黄曲霉菌株包括来自我国中温带、暖温带、亚热带和青藏高原气候区的26省区不同地理环境的具代表性的88株, 国际菌株包括模式和权威菌株9株, 包括CBS 100927T (A. flavus的模式菌株)、CBS 100925T (A. oryzae的模式菌株)、CBS 120.51T (托姆曲霉A. thomii的模式菌株)、CBS 485.65T (黄曲霉柱头变种A. flavus var. columnaris的模式菌株)和基因组测序菌株NRRL 3357和RIB40, 还有越南的3.2789、日本的3.4408、美国的3.4410, 共97株, 以及黄曲霉4个近缘种的模式菌株, 即花生曲霉(A. arachidicola CBS 117610T)、黄毒曲霉(A. aflatoxiformans CBS 143679T)、A. minisclerotigenes CBS 115635T、寄生曲霉(A. parasiticus CBS 100926T), 还有1株分离自酱曲的A. parasiticus 3.306。分子系统学分析以溜曲霉(A. tamari)的模式菌株CBS 104.13T作为外群。共计103株(表1)。
表1 黄曲霉菌株、分离地和基物及产毒特性
Table 1
| 菌株顺序号* Number | 物种 Species | 菌株 Strains | 分离地和基物 Isolation places and substrates | 产毒素 Toxin production | |
|---|---|---|---|---|---|
| AFB | CPA | ||||
| 1 | A. flavus | CBS 100927T | 南太平洋群岛; 赛璐玢 Cellophane; South Pacific Islands | - | + |
| 2 | A. oryzae | CBS 100925T | 日本大阪; 分离基物未知 Ex-type of A. oryzae, unknown source; Osaka, Japan | - | + |
| 3 | A. thomii | CBS 120.51T | 英国伦敦; 污染物 Ex-type of A. thomii, culture contaminant; London, UK | - | + |
| 4 | A. flavus | CYH2-2-1 | 河北石家庄; 空气 Air; Shijiazhuang, Hebei, China | + | + |
| 5 | A. flavus | 3.4408 | 日本东京; 土壤 Soil; Tokyo, Japan | + | + |
| 6 | A. flavus | 14527 | 西藏米林; 土壤 Soil; Milin, Tibet, China | + | + |
| 7 | A. flavus | 13483 | 山西五台山; 土壤 Soil; Mt. Wutaishan, Shanxi, China | + | + |
| 8 | A. flavus | 13868 | 内蒙古呼伦贝尔; 土壤 Soil; Hulun Buir, Inner Mongolia, China | + | + |
| 9 | A. flavus | 13894 | 湖南益阳; 土壤 Soil; Yiyang, Hunan, China | + | + |
| 10 | A. flavus | 13895 | 江西三清山; 土壤 Soil; Sanqingshan, Jiangxi, China | + | + |
| 11 | A. flavus | 13918 | 江苏苏州; 土壤 Soil, Suzhou, Jiangsu, China | + | + |
| 12 | A. flavus | 13952 | 甘肃兰州; 土壤 Soil; Lanzhou, Gansu, China | - | + |
| 13 | A. flavus | 13961 | 宁夏罗山; 土壤 Soil; Luoshan, Ningxia, China | - | - |
| 14 | A. flavus | 13962 | 宁夏灵武; 土壤 Soil; Lingwu, Ningxia, China | - | - |
| 15 | A. flavus | 14099 | 山西吕梁; 土壤 Soil; lvliang, Shanxi, China | + | + |
| 16 | A. flavus | 14131 | 山西大同; 土壤 Soil; Datong, Shanxi, China | + | + |
| 17 | A. flavus | 14151 | 河南洛阳; 土壤 Soil; Luoyang, Henan, China | - | - |
| 18 | A. flavus | 14152 | 河南南阳; 土壤 Soil; Nanyang, Henan, China | - | - |
| 19 | A. flavus | 14153 | 山东泰安 土壤 Soil; Tai’an, Shandong, China | - | - |
| 20 | A. flavus | 14154 | 山东临沂; 土壤 Soil; Linyi, Shandong, China | - | - |
| 21 | A. flavus | 14155 | 河北兴隆; 土壤 Soil; Xinglong, Hebei, China | - | - |
| 22 | A. flavus | 14156 | 河北张家口; 土壤 Soil; Zhangjiakou, Hebei, China | - | - |
| 23 | A. flavus | 14157 | 河北保定; 土壤 Soil; Baoding, Hebei, China | - | - |
| 24 | A. flavus | 14159 | 河北衡水; 土壤 Soil; Hengshui, Hebei, China | - | - |
| 25 | A. flavus | 14175 | 浙江乌镇; 土壤 Soil; Wuzhen, Zhejiang, China | + | + |
| 26 | A. flavus | 14334 | 安徽巢湖; 荸荠 Water chestnut; Chaohu, Anhui, China | + | + |
| 27 | A. flavus | 14353 | 新疆吐鲁番; 土壤 Soil; Turpan, Xinjiang, China | + | + |
| 28 | A. flavus | 14355 | 新疆石河子; 土壤 Soil; Shihezi, Xinjiang, China | + | + |
| 29 | A. flavus | 14356 | 新疆乌鲁木齐; 土壤 Soil; Urumqi, Xinjiang, China | + | + |
| 30 | A. flavus | 14357 | 新疆伊犁; 土壤 Soil; Yili, Xinjiang, China | + | + |
| 31 | A. flavus | 14358 | 陕西榆林; 土壤 Soil; Yulin, Shaanxi, China | + | + |
| 32 | A. flavus | 14359 | 陕西汉中; 土壤 Soil; Hanzhong, Shaanxi, China | + | + |
| 33 | A. flavus | 14373 | 陕西渭南; 土壤 Soil; Weinan, Shaanxi, China | + | + |
| 34 | A. flavus | 14374 | 新疆吐鲁番; 土壤 Soil, Turpan, Xinjiang, China | + | + |
| 35 | A. flavus | 23124 | 海南五指山; 土壤 Soil; Mt. Wuzhishan, Hainan, China | + | + |
表1 (续)
Table 1
| 菌株顺序号* Number | 物种 Species | 菌株 Strains | 分离地和基物 Isolation places and substrates | 产毒素 Toxin production | |
|---|---|---|---|---|---|
| AFB | CPA | ||||
| 36 | A. flavus | AB34 | 四川若尔盖; 土壤 Soil; Ruoergai Prairie, Sichuan, China | - | + |
| 37 | A. flavus | FJ17-2 | 福建宁德; 茶叶 Tea; Ningde, Fujian, China | + | + |
| 38 | A. flavus | HB4 | 湖北神农架; 土壤 Soil; Shennongjia, Hubei, China | + | + |
| 39 | A. flavus | HL53 | 黑龙江凉水; 土壤 Soil; Liangshui Nature Reserve, Heilongjiang, China | + | + |
| 40 | A. flavus | HL70 | 黑龙江乌伊岭; 土壤 Soil; Wuyiling, Heilongjiang, China | + | + |
| 41 | A. flavus | KK39 | 青海互助县; 土壤 Soil; Huzhu County, Qinghai, China | - | + |
| 42 | A. flavus | KK41 | 青海互助县; 土壤 Soil; Huzhu County, Qinghai, China | - | + |
| 43 | A. flavus | KK49 | 青海互助县; 土壤 Soil; Huzhu County, Qinghai, China | - | + |
| 44 | A. flavus | KK50 | 青海可可西里; 土壤 Soil; Hoh Xil, Qinghai, China | - | + |
| 45 | A. flavus | KK65 | 青海楚玛尔河; 土壤 Soil; Chumaer River, Qinghai, China | - | + |
| 46 | A. flavus | KK66 | 青海可可西里; 土壤 Soil; Hoh Xil, Qinghai, China | - | + |
| 47 | A. flavus | KK67 | 青海楚玛尔河; 土壤 Soil; Chumaer River, Qinghai, China | - | + |
| 48 | A. flavus | KK68 | 青海沱沱河; 土壤 Soil; Tuotuo River, Qinghai, China | - | + |
| 49 | A. flavus | KK69 | 青海沱沱河; 土壤 Soil; Tuotuo River, Qinghai, China | - | + |
| 50 | A. flavus | KK70 | 青海楚玛尔河; 土壤 Soil; Chumaer River, Qinghai, China | - | + |
| 51 | A. flavus | KK72 | 青海青海湖; 土壤 Soil; Qinghai Lake, Qinghai, China | + | + |
| 52 | A. flavus | KK73 | 青海青海湖; 土壤 Soil; Qinghai Lake, Qinghai, China | + | + |
| 53 | A. flavus | KK94 | 青海坎布拉; 土壤 Soil; Kanbula, Qinghai, China | + | + |
| 54 | A. flavus | KK102 | 青海坎布拉; 土壤 Soil; Kanbula, Qinghai, China | - | + |
| 55 | A. flavus | KK103 | 青海坎布拉; 土壤 Soil; Kanbula, Qinghai, China | - | + |
| 56 | A. flavus | KK104 | 青海坎布拉; 土壤 Soil; Kanbula, Qinghai, China | - | + |
| 57 | A. flavus | KK114 | 青海坎布拉; 土壤 Soil; Kanbula, Qinghai, China | - | + |
| 58 | A. flavus | XZ107 | 陕西南宫山; 植物叶 Plant leaves; Mt. Nangongshan, Shaanxi, China | + | + |
| 59 | A. flavus | XZ108 | 陕西通天河; 植物叶 Plant leaves; Tongtian River, Shaanxi, China | + | + |
| 60 | A. flavus | XZ109 | 陕西南宫山; 植物叶 Plant leaves; Mt. Nangongshan, Shaanxi, China | + | + |
| 61 | A. flavus | XZ112 | 陕西通天河; 植物叶 Plant leaves; Tongtian River, Shaanxi, China | + | + |
| 62 | A. flavus | YN23 | 云南玉溪; 烟叶 Tobacco leaves; Yuxi, Yunnan, China | - | + |
| 63 | A. flavus | YN35 | 云南玉溪; 烟叶 Tobacco leaves; Yuxi, Yunnan, China | + | + |
| 64 | A. flavus | YN48 | 云南玉溪; 烟叶 Tobacco leaves; Yuxi, Yunnan, China | + | + |
| 65 | A. flavus | YN49 | 云南玉溪; 烟叶 Tobacco leaves; Yuxi, Yunnan, China | + | + |
| 66 | A. flavus | YN51 | 云南玉溪; 烟叶 Tobacco leaves; Yuxi, Yunnan, China | + | + |
| 67 | A. flavus | NRRL 3357 | 美国; 霉花生 Moldy peanuts; USA | + | + |
| 68 | A. oryzae | RIB40 | 日本; 谷粒 Cereal grains; Japan | - | - |
| 69 | A. flavus | 3.262 | 辽宁大连; 空气 Air; Dalian, Liaoning, China | - | - |
| 70 | A. flavus | 3.267 | 辽宁大连; 土壤 Soil; Dalian, Liaoning, China | - | + |
| 71 | A. flavus | 3.337 | 天津; 蚊香 Mosquito-repellent incense; Tianjin, China | - | + |
| 72 | A. flavus | 3.417 | 天津; 酱曲 Soy sauce starter; Tianjin, China | - | + |
| 73 | A. flavus | 3.870 | 天津; 酱曲 Soy sauce starter; Tianjin, China | + | + |
| 74 | A. flavus | 3.881 | 上海; 小麦 Wheat; Shanghai, China | - | + |
| 75 | A. flavus | 3.2146 | 北京; 大米 Rice; Beijing, China | + | + |
| 76 | A. flavus | 3.2758 | 广东广州; 空气 Air; Guangzhou, Guangdong, China | - | + |
| 77 | A. flavus | 3.2789 | 越南河内; 土壤 Soil; Hanoi, Vietnam | - | + |
| 78 | A. flavus | 3.2823 | 安徽芜湖; 植物 Plants; Wuhu, Anhui, China | - | + |
表1 (续)
Table 1
| 菌株顺序号* Number | 物种 Species | 菌株 Strains | 分离地和基物 Isolation places and substrates | 产毒素 Toxin production | |
|---|---|---|---|---|---|
| AFB | CPA | ||||
| 79 | A. flavus | 3.3554 | 北京; 空气 Air; Beijing, China | - | + |
| 80 | A. flavus var. columnaris | CBS 485.65T | 日本; 黄油 Ex-type of A. flavus var. columnaris, butter; Japan | - | + |
| 81 | A. flavus | 3.4408-2 | 北京; 空气 Air; Beijing, China | + | + |
| 82 | A. flavus | 3.4410 | 美国 ATCC 28539; USA | + | + |
| 83 | A. flavus | 3.5211 | 北京 CICC 2348; Beijing, China | - | + |
| 84 | A. flavus | 3.5278 | 四川德阳; 烂水果 Rotten fruit; Deyang, Sichuan, China | + | + |
| 85 | A. flavus | 3.5283 | 四川成都; 土壤 Soil; Chengdu, Sichuan, China | + | + |
| 86 | A. flavus | 3.5309 | 四川都江堰; 土壤 Soil; Dujiangyan, Sichuan, China | + | + |
| 87 | A. flavus | 3.5329 | 贵州梵净山; 皮革 Leather; Mt. Fanjingshan, Guizhou, China | + | + |
| 88 | A. flavus | 3.6153 | 山东泰安; 小麦 Wheat; Tai’an, Shandong, China | - | + |
| 89 | A. flavus | 3.6304 | 广西宜山; 玉米 Corn; Yishan, Guangxi, China | - | + |
| 90 | A. flavus | 3.6307 | 吉林珲春; 亚麻 Linen; Hunchun, Jilin, China | + | + |
| 91 | A. flavus | 3.6311 | 广东广州; 空气 Air; Guangzhou, Guangdong, China | + | + |
| 92 | A. flavus | 3.6422 | 河北小五台山; 松果 Pinecore; Mt. Small Wutaishan, Hebei, China | + | + |
| 93 | A. flavus | 3.6428 | 云南大理; 霉纸 Mouldy paper; Dali, Yunnan, China | + | + |
| 94 | A. flavus | 3.6431 | 云南大理; 玉米叶 Corn leaves; Dali, Yunnan, China | + | + |
| 95 | A. flavus | 3.6434 | 云南思茅; 土壤 Soil; Simao, Yunnan, China | - | + |
| 96 | A. flavus | 14160 | 河南信阳; 土壤 Soil,; Xinyang, Henan, China | - | - |
| 97 | A. flavus | FJ17 | 福建宁德; 茶叶 Tea; Ningde, Fujian, China | + | + |
| A. arachidicola | CBS 117610T | 阿根廷; 花生叶 Arachis glabrata leaves; Argentina | |||
| A. minisclerotigenes | CBS 115635T | 阿根廷; 花生 Arachis hypogaea seeds; Argentina | |||
| A. parasiticus | CBS 100926T | 美国夏威夷; 嗜桔粉蚧 Pseudococcus calceolariae; Hawaii, USA | |||
| 3.306 | 天津; 酱曲 Soy sauce starter; Tianjin, China | ||||
| A. aflatoxiformans | CBS 143679T | 尼日利亚; 土壤 Soil; Nigeria | |||
| A. tamarii | CBS 104.13T | 分离地未知; 活性碳 Activated carbon; unknown country | |||
* The reference numbers and colours of words are in accordance with
* 菌株顺序号与
DNA提取、两个直源基因(orthologous genes)该调蛋白基因(calmodulin gene, CaM)和beta-微观蛋白基因(beta-tubulin gene, BenA)的PCR引物及扩增方法分别参考Wang和Zhuang (2004), Wang (2012), Glass and Donaldson (1995)。PCR产物测序由生物技术公司完成。数据处理: 核酸序列用Bioedit 7.0.9 (Hall, 1999)编辑校对, 校对好的CaM和BenA基因序列链接成1026 bp的序列。分子系统学分析: 上述103个菌株的CaM和BenA链接序列用软件MEGA 6.0 (Tamura et al, 2011)的MUSCLE功能做对位排列(alignment)后, 进行最大似然法(maximum likelihood, ML)分析(碱基替换模型为Kimura-2), 并进行1,000次bootstrap检验(图1)。居群结构推导: 将链接后的97株黄曲霉的CaM和BenA基因序列使用Structure 2.3.4进行居群推导。在burn-in过程采用100,000次链重复, 然后进行100,000次Markov Chain Monte Carlo重复, 将推导居群数设为1-6, 最佳居群数目由Structure Harvester确定。
2 结果
2.1 黄曲霉物种界定
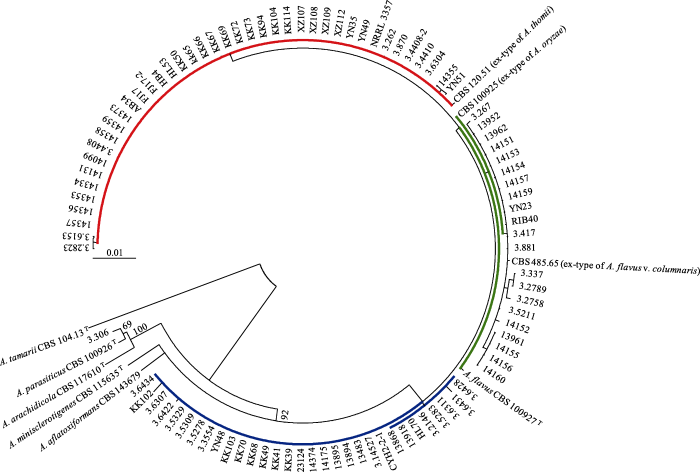
ML分析结果显示A. oryzae、A. thomii和A. flavus var. columnaris的模式菌株CBS 100925T、CBS 120.51T、CBS 485.65T与A. flavus的模式菌株CBS 100927T同在一个分支, bootstrap支持率为92%, 明显与其5个近缘种分开, 因此A. oryzae、A. thomii和A. flavus var. columnaris均应称为A. flavus。但由于A. oryzae广泛应用于食品工业并被大众所接受, 真菌分类学者建议保留该名称, 在本研究中将其作为A. flavus的一个居群的名称(图1)。
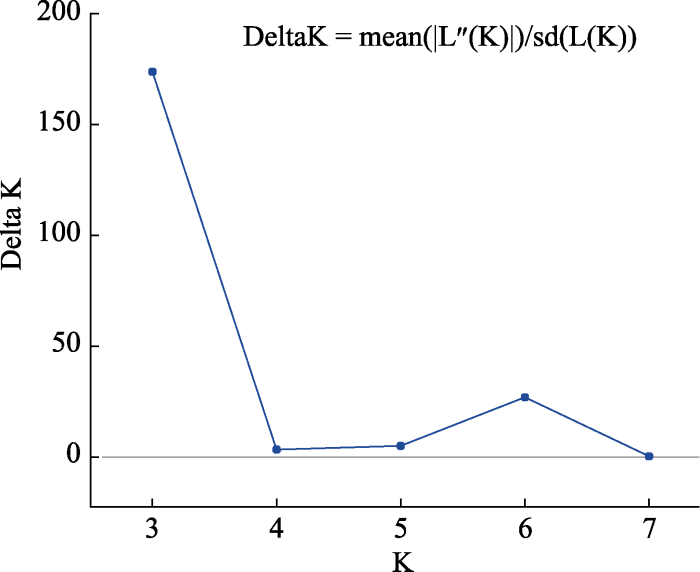
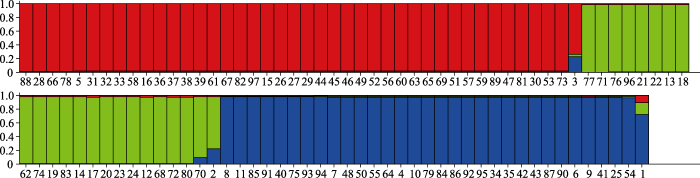
2.2 黄曲霉居群的确定
Structure 2.3.4推导出的居群最佳数目为3个居群, 分别用红色、绿色和蓝色区分(图1, 3)。表2、图1-3显示我国的88株黄曲霉和9株国际黄曲霉菌株可以划分为3个居群。第一个居群共42株, 该群菌株变异较小(图1, 3中以红色标记), 只有4个序列型(sequence type, ST)。第一个序列型有2个菌株: 3.2823和3.6153; 第二个序列型也有2个菌株: 14355和YN51; 第三个序列型只有1个菌株, 即A. thomii的模式菌株CBS 120.51T; 第4个序列型包含剩余的37株菌, 以基因组测序菌株NRRL 3357为代表, 该群在本研究中称为黄曲霉居群I (A. flavus population I)。
图1
图1
97株黄曲霉及其4个近缘种的ML系统发育树。黄曲霉模式菌株CBS 100927T、黄曲霉柱头变种模式菌株CBS 485.65T、米曲霉模式菌株CBS 100925T和托姆曲霉模式菌株CBS 120.51T同在一个分支, 支持率为92%, 溜曲霉模式菌株CBS 104.13T作为外群。红、绿、蓝颜色与
Fig. 1
The maximum likelihood phylogram of 97 Aspergillus flavus strains and its four close-related species. The ex-type of A. flavus CBS 100927T, ex-type of A. flavus var. columnaris CBS485.65T, ex-type of A. oryzae CBS 100925T, and ex-type of A. thomii CBS 120.51T are in the same clade with a 92% support, with the ex-type of A. tamari CBS 104.13T as the outgroup. The red, green and blue colours are in accordance with
表2 由Structure 2.3.4根据Delta K推导出的最佳居群数目K
Table 2
| K | Replicates | Mean LnP(K) | Stdev LnP(K) | Ln°(K) | |Ln(K)| | Delta K |
|---|---|---|---|---|---|---|
| 2 | 20 | -252.900000 | 11.116323 | - | - | - |
| 3 | 20 | -153.585000 | 0.665918 | 99.315000 | 115.770000 | 173.850119 |
| 4 | 20 | -170.040000 | 4.371607 | -16.455000 | 14.975000 | 3.425514 |
| 5 | 20 | -171.520000 | 3.293790 | -1.480000 | 16.860000 | 5.118723 |
| 6 | 20 | -189.860000 | 14.895474 | -18.340000 | 402.695000 | 27.034721 |
| 7 | 20 | -610.895000 | 1,768.728466 | -421.035000 | 779.785000 | 0.440873 |
| 8 | 20 | -252.145000 | 53.166892 | 358.750000 | — | — |
图2
图2
Structure Harvester计算得到的最佳居群数目(delta K = 3为最佳)
Fig. 2
The best population numbers calculated by Structure Harvester (the best number is 3 for delta K)
第二个居群共23株(图1, 3中以绿色标记), 该群变异较大, 除了CBS 100925T为1个序列型外, 我国菌株占6个序列型, 共有7个序列型: 第一个序列型只有米曲霉模式菌株CBS 100925T; 第二个序列型只有菌株3.267; 第三个序列型包括3.337和3.2789; 第四个序列型只有3.2758; 第五个序列型只有14152; 第六个序列型有4株菌: 13961、14155、14156和14160; 第七个序列型包括了剩余的13株菌, 其中有基因组测序菌株RIB40和黄曲霉柱头变种的模式菌株CBS 485.65, 用于工业生产酱油的菌株RIB40, 3.417, 3.5211以及分离自不同地区环境的10株菌在CaM和BenA序列上没有差别。米曲霉模式菌株CBS 100925T并不属于这个居群的典型成员, 黄曲霉柱头变种的模式菌株CBS 485.65T和基因组测序菌种RIB40是这个居群的典型代表, 该群在本研究中称为米曲霉居群(population A. oryzae)。
第三个居群共32株, 除A. flavus模式菌株CBS 100927T外全部由我国菌株组成(表1, 图1, 3中以蓝色标记)。该群共有6个序列型: 第一个序列型只有A. flavus模式菌株CBS 100927T; 第二个序列型只有3.6431; 第三个序列型有7个菌株: 3.6428、3.6311、3.5283、3.2146、HL70、13918和13868; 第四个序列型也只有1个菌株3.6422; 第五个序列型也只有1株菌KK102; 第六个序列型包含剩余的21株菌。该群在本研究中称为黄曲霉居群II (A. flavus population II)。A. flavus模式菌株CBS 100927T的位置在图1, 3中发生矛盾, 在图1中它属于米曲霉居群, 而在图3中则属于黄曲霉居群II。由于它是黄曲霉的模式菌株, 根据Structure给出的结果, 我们将它放在黄曲霉居群II中。
图3
图3
97株黄曲霉由Structure Harvester计算得到3个居群。红色, 绿色和蓝色分别代
Fig. 3
The three populations of the 97 Aspergillus flavus isolates calculated by Structure Harvester. Red, green and blue colours stand for the three different populations, each column stands for each strain, and the number under each column is in accordance with those in
2.3 菌株的产毒特性
总体上米曲霉居群都不产AFB, 而另外2个黄曲霉居群绝大多数产AFB和CPA, 但产毒特性只具有菌株特异性, 与居群和序列型无关。比如黄曲霉居群I的42株菌中分属于两个不同序列型的12株(3.2823、3.6153、3.6304、3.262、KK114、KK104、KK69、KK67、KK66、KK65、KK50、AB34)都不产AFB, 而剩余的30株菌虽然属于3个不同序列型,但均产AFB; 该居群只有菌株3.262不产CPA, 其他41株菌分属四个序列型都产CPA。
黄曲霉居群II的32株菌共分6个序列型。其中属于两个不同序列型的10株不产AFB (CBS 100927T、KK39、KK41、KK49、KK68、KK70、KK102、KK103、3.3554、3.6434), 其他3个不同序列型的21株菌均产AFB。另外, 该群菌株这6个序列型均产生CPA (表1)。
同属一个序列型的菌株, 有些产AFB和/或CPA, 有些则不产。例如黄曲霉居群I的42株菌中, 除 3.2823、3.6153、14355、YN51、CBS 120.51T外, 其余的37株同属一个序列型, 只有10株不产AFB(3.6304、3.262、KK114、KK104、KK69、KK67、KK66、KK65、KK50、AB34), 而剩余的27株均产AFB。另外, 该序列型只有菌株3.262不产CPA, 其他36株都产CPA。
米曲霉居群7个序列型的23株菌均不产生AFB, 而分别属于5个序列型的11株菌(CBS 100925T、3.267、13952、YN23、3.417、3.881、CBS 485.65T、3.337、3.2789、3.2758、3.5211)均产CPA。同属一个序列型的13株菌有7株既不产AFB也不产CPA(13962、14151、14153、14154、14157、14159、RIB40), 另外6株产CPA(13952、YN23、3.417、3.881、3.5211、CBS 485.65T)。
2.4 产毒特性与地理分布
分离自我国东北的黑龙江凉水(HL53)和乌伊岭(HL70)以及内蒙古呼伦贝尔(13868)的菌株分别属于黄曲霉居群I和II, 均产AFB和CPA。分离自我国西北的陕西(XZ112、XZ109、XZ108、XZ107、14373、14359、14358)和新疆(14357、14356、14353、14355、14374)的菌株也都产AFB和CPA。但分离自我国可可西里和阿坝地区的菌株不产AFB, 如黄曲霉居群I的KK114、KK104、KK69、KK67、KK66、KK65、KK50、AB34以及居群II的KK39、KK41、KK49、KK68、KK70、KK103。另外, 不产AFB和CPA的米曲霉群菌株大部分分离自我国华北的河北、河南和山东地区, 如14151、14153、14154、14157、14159、14152、14155、14156、14160(表1)。
3 讨论
3.1 遗传标记的选择和我国黄曲霉的居群结构
居群(population)是物种演化(evolution)的最小单位, 只有共享衍生性状(shared derived characters)才能反映种系发生学(phylogenetics)的信息。因此, 只有直源基因才能作为分子种系学研究的遗传标记。但要注意的是有些直源基因是多拷贝的, 如果在PCR扩增过程中将不同拷贝扩增出来用于种系学分析会得到错误的结论。所以理论上只有单拷贝直源基因(single copy orthologous genes)才适用于分子系统学研究。而次级代谢基因簇的基因属于非直源基因, 所以不适用于分子种系学。例如Geiser等(2000)根据3个基因(amdS, omt12, trpC13)片段序列(其中omt12是非直源基因, 属于AF生物合成基因簇)将33株黄曲霉和3株米曲霉分为2个群Group I和Group II。Group I包括产大核和小核菌株, 均不产生AFG。该群又分为3个亚群: IA菌株产大核和小核, 多数产生AFB和CPA, 有些不产AFB; IB菌株产大核, 均不产生AFB和AFG, 但有些产生CPA, 有些不产, 并包括部分米曲霉菌株; IC菌株产大核, 均不产AFG, 多数产AFB和CPA, 少数产AFB但不产CPA。Group II菌株产生AFB、AFG和CPA, 且产小核。
Varga等(2011)根据AF生物合成基因簇的3个基因: aflR、norA和omtA片段序列对Aspergillus section Flavi 22个种的系统发育学分析显示, norA和omtA均无法区分A. flavus和A. minisclerotigenes。其omtA的系统树显示3株A. flavus中的一株A. flavus SRRC 1007与A. thomii聚在一个分支, 另一株A. flavus NPL TX5-1与A. minisclerotigenes处于同一分支, 而第三株A. flavus CRA01-2B单独形成一个分支。在青霉与曲霉的分子系统学分析中广泛使用的3个直源基因(rDNA ITS1-5.8S-ITS2, BenA和CaM)中, ITS1-5.8S-ITS2在真菌中有200-300个拷贝, beta- tubulin gene有3个拷贝(benA, benB, benC), calmodulin gene只有一个拷贝(CaM)。本研究选择CaM和benA作为遗传标记用于黄曲霉的遗传多样性研究具有客观可靠性。
“黄曲霉”遗传多样性的研究由于使用了非直源基因以及模糊的物种概念导致其居群结构的划分相当混乱。Chang等(2006)根据AF生物合成基因簇的omtA片段序列(约594 bp)的33个单核苷酸多态(SNP)位点、产AFB特征及norB-cypA区缺失类型对29株“典型”黄曲霉和4株米曲霉进行系统发育学分析, 认为“典型”黄曲霉可分为3个分化支(clade), 米曲霉可分为2个分化支。Clade I由不产毒的大核菌株和米曲霉Clade 1菌株组成, norB-cypA区的缺失类型均为I型缺失, 该支相当于Geiser等(2000)的IB群; Clade II包含产AFB的小核菌株和不产AFB的大核菌株, norB-cypA区的缺失类型为I型缺失, 该支相当于Geiser等(2000)的IA群; Clade III由产生和不产生AFB的大核菌株和米曲霉Clade 2菌株组成, norB- cypA区的缺失类型为I型或II型缺失, 其中米曲霉为I型缺失, 该支类似于Geiser等(2000)的IC群, 但Geiser等(2000)的IC群大多数产AFB。然而Chang和Eherlich (2010)根据CPA生物合成基因簇的dmaT单核苷酸多态性的分析并不支持米曲霉两个分支的划分, 其菌株与I型缺失的“典型”黄曲霉处于同一个分支。“典型”黄曲霉可分为三个群, 第一群: 产大核或小核, 多数产生AFB和CPA, 少数不产AFB, norB-cypA区为I型缺失。第二群: 产大核, 不产AFB但产生或不产生CPA, 包括部分A. flavus菌株, norB-cypA区为I型缺失。第三群: 产大核, 多数产生AFB和CPA, 还有一些菌株不产AFB, 包括部分A. flavus菌株; norB-cypA区为I型或II型缺失。Batista等(2008)用ISSR的方法将来自巴西的16株A. flavus分为2个群, 并认为其中一个群与地理来源具有较高的相关性。但基于ISSR对A. flavus 进行居群划分的研究相对比较匮乏, 其客观性尚待讨论。菌核的产生与否及其大小, 毒素的产生与否及其种类, 黄曲霉素生物合成基因簇norB-cypA区的缺失类型以及次级代谢基因序列omtA、norA和dmaT均无法明确A. flavus居群的划分, 而且上述3个次级代谢基因在不同的研究中得出的结果不同。因此无法使用非直源基因用于居群结构的推导。
我们根据2个直源基因使用2种分析方法划分黄曲霉的3个居群基本上是一致的。Structure给出的结果比较明确, 而ML的结果缺乏统计学支持率, 但ML法能显示一些基因型上的差别。比如第一个居群的42株菌中可以分为4个序列型, 第一个序列型占优势, 共有37株, 以NRRL 3357为代表。第二个序列型由3.2823和3.6153组成, 这2株菌均不产生AFB。第三个序列型也包括2株菌, 即14355和YN51, 这2株菌均产生AFB。第四个序列型为CBS 120.51T, 该菌株是A. thomii的模式菌株, Structure的结果也显示它与其他菌株有差异。
第二个居群, 即米曲霉居群的23株菌, 在遗传上变异较大, 共有7个序列型。Structure和ML在菌株CBS 100927T的归群上有矛盾, Structure将其归在黄曲霉居群II内, ML显示其不在任何一个群内, 但由于它是A. flavus的模式菌株, 我们根据Structure推导的结果把它归在黄曲霉居群II中。米曲霉居群遗传变异相当大, 可以推测这个居群遗传学上相对不稳定, 易于导致黄曲霉毒素合成酶某些基因缺失或突变从而失去AFB或AFG合成能力。例如Eherlich等(2004)和Chang等(2006)发现“典型”黄曲霉和米曲霉在AF生物合成基因簇的norB-cypA区具有2类缺失(deletion): 具有1.5 kb的缺失称为I型(Type I)缺失, 具有1.0 kb的缺失称为II型(Type II)缺失。这两类缺失均阻止一种细胞色素P450单加氧酶的生物合成, 而这种酶正是AFG合成所必需的, 因此“典型”黄曲霉和米曲霉不可能产生AFG (迄今只发现了2个韩国菌株能产生AFG (Frisvad et al, 2019)。
3.2 黄曲霉产毒特性和地理分布
通常高温、干旱环境适合黄曲霉的生存和繁殖, 黄曲霉毒素合成基因能在此环境中被激活从而产生大量黄曲霉毒素(Medina et al, 2017)。另外, 作物类型对黄曲霉具有选择作用, 尤其是玉米、花生和棉花。在高温、干旱环境中这些农作物的免疫力降低从而易受黄曲霉的侵染(Horn et al, 1995; Cotty & Jaime-Garcia, 2007; Horn, 2003)。因此, 黄曲霉侵染及产毒特性与地理分布和农作物类型存在较为密切的关系。从我们的结果来看, 我国东北玉米产区的黑龙江和内蒙古菌株以及我国西北干旱棉花产区的陕西和新疆的黄曲霉菌株均产AFB和CPA, 我国南方种植花生的地区菌株也都产AFB和CPA。玉米、花生是各种动物(包括昆虫)喜欢的食物, 感染黄曲霉后动物拒绝采食, 可能提高了黄曲霉的生存繁殖几率。而我国青海可可西里和四川阿坝地区的黄曲霉虽然产CPA但多数菌株不产AFB。华北地区玉米、花生和棉花都广泛种植, 自然环境和农作物种类差异较大, 产毒和不产毒菌株普遍分布, 生态多样性与遗传多样性相辅相成。但有意思的是, 不产AFB和CPA的米曲霉居群大部分来自我国华北地区, 如河北、河南和山东, 这些地区是我国农村用传统方法酿造黄豆酱的地区。传统制酱采用蒸熟的黄豆自然晾晒进行空气接种的方式, 空气中的米曲霉作为酱曲被我国劳动人民所利用, 这也印证了一句谚语“一方水土养一方人”。
致谢:感谢西北农林科技大学王博和长江大学余芸帮助野外考察采样和菌株分离。
参考文献
Aspergillus flavus population isolated from soil of Argentina’s peanut-growing region. Sclerotia production and toxigenic profile
Genetic characterization of Brazilian strains of Aspergillus flavus using DNA markers
Mycotoxins: Risks in plant, animal and human systems. Task Force Report No. 139, 13-85. CAST, Ames, IA
What does genetic diversity of Aspergillus flavus tell us about Aspergillus flavus?
Cladal relatedness among Aspergillus flavus isolates and Aspergillus flavus S and L morphotype isolates
Aflatoxin-producing potential of communities of Aspergillus section Flavi from cotton producing areas in the United States
Virulence and cultural characteristics of two Aspergillus flavus strains pathogenic on cotton
Influence of climate on aflatoxin producing fungi and aflatoxin contamination
Aflatoxin biosynthesis cluster gene cypA is required for G aflatoxin formation
Taxonomic comparison of three different groups of aflatoxin producers and a new efficient producer of aflatoxin B1, sterigmatocystin and 3-O-methylstergmatocystin, Aspergillus rambellii sp. nov
Taxonomy of Aspergillus section Flavi and their production of aflatoxins, ochratoxins and other mycotoxins
Contamination of aflatoxins in peanuts from some regions in China
中国部分地区花生中4种黄曲霉毒素污染调查. 中国公共卫生,
The phylogenetics of mycotoxin and sclertium production in Aspergillus flavus and Aspergillus oryzae
Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes
BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT
Aspergillus flavus: Human pathogen, allergen and mycotoxin producer
Effect of corn and peanut cultivation on soil populations of Aspergillus flavus and A. parasiticus in southwestern Georgia
Regional differences in production of aflatoxin B1 and cyclopiazonic acid by soil isolates of Aspergillus flavus along a transect within the United States
Ecology and population biology of aflatoxingenic fungi in soil. Journal of Toxicology-Toxin Reviews
Aspergillus flavus: An emerging non-fumigatus Aspergillus species of significance
DNA relatedness among wild and domesticated species in the Aspergillus flavus Group
Interactions between water activity and temperature on the Aspergillus flavus transcriptome and aflatoxin B1 production
Spatial and temporal patterns of Aspergillus flavus strain composition and propagule density in Yuma County, Arizona, soils
How will climate change affect mycotoxins in food?
Two novel aflatoxin-producing Aspergillus species from Argentinean peanuts
Fungi and Food spoilage, 3rd edn. Springer-Science Media, London
A new variety of Aspergillus flavus from tropical soil in Thailand and its aflatoxin productivity
A survey on distribution and toxigenicity of Aspergillus flavus from indoor and outdoor hospital environments
MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods
Two new aflatoxin producing species, and an overview of Aspergillus section Flavi
Designing primer sets for amplification of partial calmodulin genes from penicillia
Four new records of Aspergillus section Usti from Shandong Province, China
Study of pectinase and sclerotium producing abilities of two kinds of Aspergillus flavus isolated from Zhejiang